宮頸癌
宮頸癌是全球女性第二常見的癌癥,每年估計發生約500,000例病例和超過270,000例死亡 [1]。宮頸癌是女性宮頸細胞發生變化導致的,宮頸連接子宮與陰道。
目前,越來越多的科學研究表明的科學研究表明宮頸癌是一種性傳播疾病,由某些高風險的致癌型人乳頭狀瘤病毒(HPV)感染引起,該病毒是約100種相關病毒的一組。其中,HPV 16是最重要的高風險HPV型別,HPV 18是第二常見的。高風險HPV與其他HPV型別的區別在于其兩個蛋白質E6和E7的致癌特性,這些蛋白質可能干擾細胞調控和分化。
在癌癥中,HPV E6蛋白可以對細胞腫瘤抑制基因p53產生作用。 p53基因的改變通常包括缺失、插入和點突變。p53基因負調控細胞周期,腫瘤形成通常需要“功能喪失”突變 [2]。癌癥中的E7蛋白似乎是由于其對Rb基因產物及其相關蛋白p107和p130的作用 [3] [4]。在細胞周期的正常細胞增殖過程中,受到cyclins和cyclin dependent kinases (cdk)的影響,它們相互作用并磷酸化底物,如Rb蛋白(圖1所示)。
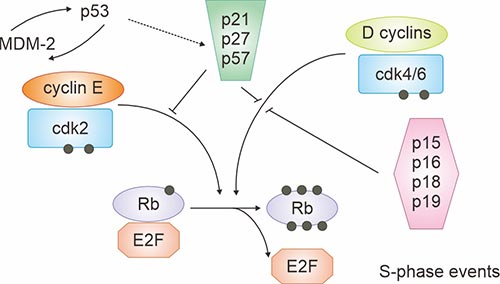
圖1. G1進程的調節因子
*此圖表來自Cancer [4] 的出版物
宮頸癌的全面基因組分析揭示了一些新的基因突變和擴增。這些突變的基因包括SHKBP1、CASP8、HLA-A、TGFBR2和ERBB3(約占腫瘤的6%等)。在本文中,我們根據NCG網站提供的信息列出了宮頸癌中涉及的部分蛋白質。NCG是一個用于分析癌癥基因的重復性、同源性和網絡特性的網絡資源。
在此,我們展示了參與宮頸癌發生機制的幾個關鍵靶點,包括:
● FBXW7(F-box和WD重復結構域蛋白7)是一個編碼Skp1-Cul1-F-box蛋白(SCF)泛素連接酶亞基的基因。SCF FBXW7靶向一組眾所周知的癌基因蛋白,包括c-Myc、cyclin E、Notch、c-Jun和Mcl-1,進行泛素化和降解 [5] [6]。據報道,FBXW7參與調控許多細胞過程,包括細胞增殖、細胞周期、凋亡和分化 [7] [8]。在宮頸鱗狀細胞癌中,FBXW7經常發生突變 [9]。
● HLA-B(主要組織相容性復合體I類B)是一組稱為人類白細胞抗原(HLA)復合體的基因的一部分。HLA復合體幫助免疫系統區分自身蛋白和病毒、細菌等外來入侵者制造的蛋白。人類白細胞抗原(HLA)基因高度多態,并且已被證明是HPV感染持續和疾病進展的重要風險因素 [10]。
● NFE2L2(核因子、類似于2的紅細胞)是一個對氧化還原敏感的轉錄因子,在食管、甲狀腺和其他組織中廣泛表達 [11]。NFE2L2介導的氧化應激是宮頸癌的一個顯著特征,促進宮頸癌細胞的增殖,抑制細胞凋亡,并增強細胞的遷移和侵襲能力,同時增加腫瘤的化療抗藥性 [12]。
● PIK3CA(磷酸肌醇-4,5-二磷酸3-激酶)是I類PI 3-激酶催化亞單位。TCGA宮頸鱗狀細胞癌研究中,PIK3CA突變的患病率為27.1%。同時,PIK3CA突變的宮頸癌顯示出比非突變癌癥更高的腫瘤突變負荷(TMB)[13]。新出現的證據表明,在攜帶放大的PIK3CA基因的宮頸癌細胞系中,PIK3CA基因產物(p110α)的表達增加,隨后與高激酶活性相關聯。
參考文獻:
[1] Mammas I, Sourvinos G, Giannoudis A, Spandidos D. Human papillomavirus (HPV) and host cellular interactions [J]. Pathol Oncol Res. 2008, 14:345-54.
[2] Okechukwu A. Ibeanu. Molecular pathogenesis of cervical cancer [J]. Cancer Biology & Therapy. 2011, 11:3, 295-306.
[2] Levine, A.J. et al. The p53 tumor suppressor gene [J]. Nature. 1991, 351,453–456.
[3] Vogelstein, B. and Kinzler, K.W. The multistep nature of cancer [J]. Trends Genet. 1993, 9, 138–1341.
[4] Pamela T. Soliman, Brian M. Slomovitz, Judith K. Wolf. Mechanisms of cervical cancer [J]. Cancer. 2004, 2(1): 1740-6765.
[5] Cheng Y, Li G. Role of the ubiquitin ligase Fbw7 in cancer progression [J]. Cancer Metastasis Rev. 2012, 31:75–87.
[6] Li M, Ouyang L, Zheng Z, et al. E3 ubiquitin ligase FBW7alpha inhibits cholangiocarcinoma cell proliferation by downregulating c-Myc and cyclin E [J]. Oncol Rep. 2017, 37:1627–1636.
[7] Welcker M, Clurman BE. FBW7 ubiquitin ligase: a tumour suppressor at the crossroads of cell division, growth and differentiation [J]. Nat Rev Cancer. 2008, 8:83–93.
[8] Jiang Y, Qi X, Liu X, et al. Fbxw7 haploinsufficiency loses its protection against DNA damage and accelerates MNU-induced gastric carcinogenesis [J]. Oncotarget. 2017, 8:33444–33456.
[9] Faying Liu, Yang Zou, Feng Wang, et al. FBXW7 Mutations Promote Cell Proliferation, Migration, and Invasion in Cervical Cancer [J]. Genet Test Mol Biomarkers. 2019, 23(6):409-417.
[10] Anna Paaso, Anna Jaakola, Stina Syrj?nen et al. From HPV Infection to Lesion Progression: The Role of HLA Alleles and Host Immunity [J]. Acta Cytol. 2019, 63(2):148-158.
[11] M. H?m?l?inen, H.-R. Teppo, S. Skarp et al., NRF1 and NRF2 mRNA and protein expression decrease early during melanoma carcinogenesis: an insight into survival and microRNAs [J]. Oxidative Medicine and Cellular Longevity. 2019.
[12] Qiang Ju , Xinmei Li, Heng Zhang et al. NFE2L2 Is a Potential Prognostic Biomarker and Is Correlated with Immune Infiltration in Brain Lower Grade Glioma: A Pan-Cancer Analysis [J]. Role of Redox Homeostasis in Cancer Biology and Anticancer Therapy. 2020.
[13] Yen Ying Ma, Sung Jen Wei, Yu Chen Lin et al. PIK3CA as an oncogene in cervical cancer [J]. Oncogene. 2000, 19(23), 2739-2744.






