淋巴毒素β受體(LTBR)研究全景:結(jié)構(gòu)、功能、疾病關(guān)聯(lián)與藥物研發(fā)新進(jìn)展
日期:2025-02-10 08:56:20
淋巴毒素β受體(LTBR)的結(jié)構(gòu)、功能及在疾病與藥物研發(fā)中的研究進(jìn)展淋巴毒素β受體(Lymphotoxin-β Receptor,LTBR),又稱(chēng)腫瘤壞死因子受體超家族成員3(TNFRSF3),在免疫系統(tǒng)中占據(jù)關(guān)鍵地位,對(duì)維持機(jī)體免疫平衡及健康狀態(tài)意義重大。隨著研究的不斷深入,其在疾病發(fā)生發(fā)展過(guò)程中的作用機(jī)制逐漸明晰,為相關(guān)疾病的治療提供了重要的理論依據(jù)。本文將圍繞LTBR的結(jié)構(gòu)、功能、信號(hào)轉(zhuǎn)導(dǎo)路徑、在免疫調(diào)控中的作用、與疾病的關(guān)聯(lián)以及相關(guān)藥物研發(fā)進(jìn)展展開(kāi)深入討論。
1. LTBR的基本結(jié)構(gòu)與功能
1.1 LTBR的結(jié)構(gòu)特征
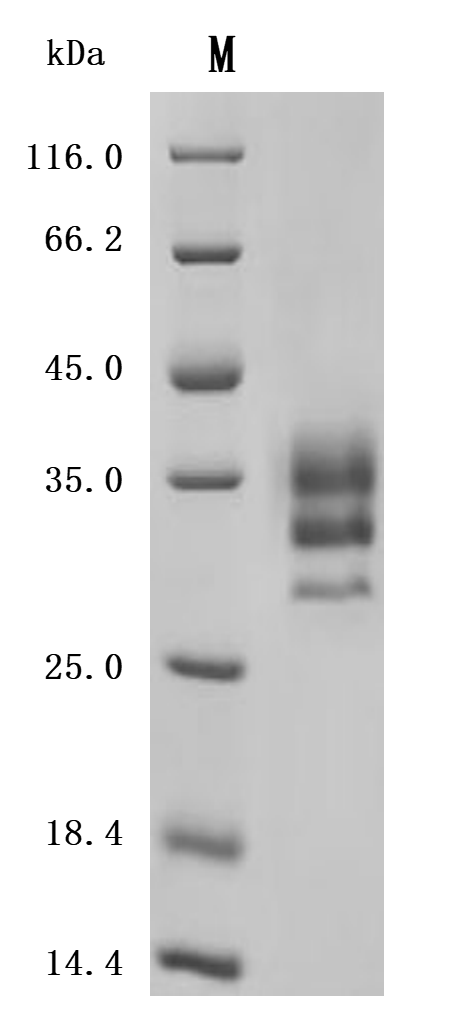
LTBR 屬于Ⅰ型單跨膜蛋白 [1],是腫瘤壞死因子受體(TNFR)家族的成員 [2]。完全糖基化的LTBR分子量為61kDa,去除糖基化修飾后,理論分子量降至47kDa [3]。其胞質(zhì)結(jié)構(gòu)域由 175 個(gè)氨基酸組成,靠近細(xì)胞膜區(qū)域富含脯氨酸殘基,這一結(jié)構(gòu)特點(diǎn)使其能像其他TNFR家族蛋白一樣,直接與腫瘤壞死因子受體相關(guān)因子(TRAF)蛋白相互作用,在細(xì)胞信號(hào)傳導(dǎo)中發(fā)揮關(guān)鍵作用 [4]。LTBR蛋白結(jié)構(gòu)包括胞外區(qū)、跨膜區(qū)和胞內(nèi)區(qū)(圖 1)。胞外區(qū)負(fù)責(zé)與配體結(jié)合,識(shí)別特定信號(hào)分子;胞內(nèi)區(qū)則通過(guò)與TRAF蛋白相互作用,啟動(dòng)細(xì)胞內(nèi)信號(hào)傳導(dǎo)通路,進(jìn)而調(diào)控細(xì)胞的生物學(xué)行為 [5]。

圖1:LTBR蛋白的結(jié)構(gòu)組成
圖源:https://www.uniprot.org/uniprotkb/P36941/entry
1.2 LTBR的表達(dá)與分布
LTBR在多種免疫細(xì)胞中均有表達(dá),如淋巴組織中的成纖維細(xì)胞網(wǎng)狀細(xì)胞、內(nèi)皮細(xì)胞、上皮細(xì)胞和髓系細(xì)胞等 [6]。盡管T細(xì)胞、B細(xì)胞和NK細(xì)胞不表達(dá)LTBR,但它對(duì)這些細(xì)胞的功能調(diào)節(jié)具有間接且重要的影響。
2. LTBR在免疫系統(tǒng)中的角色
2.1 LTBR對(duì)免疫細(xì)胞功能的調(diào)控
LTBR參與細(xì)胞凋亡和細(xì)胞因子釋放等過(guò)程,是免疫系統(tǒng)中細(xì)胞間通訊和免疫反應(yīng)調(diào)節(jié)的重要參與者 [7]。在免疫應(yīng)答過(guò)程中,LTBR通過(guò)調(diào)節(jié)細(xì)胞因子的釋放,影響免疫細(xì)胞的活化和遷移,進(jìn)而調(diào)控免疫反應(yīng)的強(qiáng)度和方向。研究顯示,LTBR信號(hào)通路的激活可促進(jìn)T細(xì)胞和B細(xì)胞的增殖與分化,增強(qiáng)免疫應(yīng)答 [8]。
2.2 LTBR與淋巴組織發(fā)育的關(guān)系
在次級(jí)淋巴器官的發(fā)育過(guò)程中,LTBR 發(fā)揮著不可或缺的作用 [9]。在胚胎發(fā)育階段,LTBR 信號(hào)通路的激活促使淋巴器官原基的形成,隨后調(diào)節(jié)免疫細(xì)胞的歸巢和分化,使得淋巴結(jié)、脾臟等淋巴器官得以正常發(fā)育。此外,LTBR還參與淋巴組織的重塑和維持,對(duì)免疫系統(tǒng)的正常運(yùn)作至關(guān)重要 [10]。
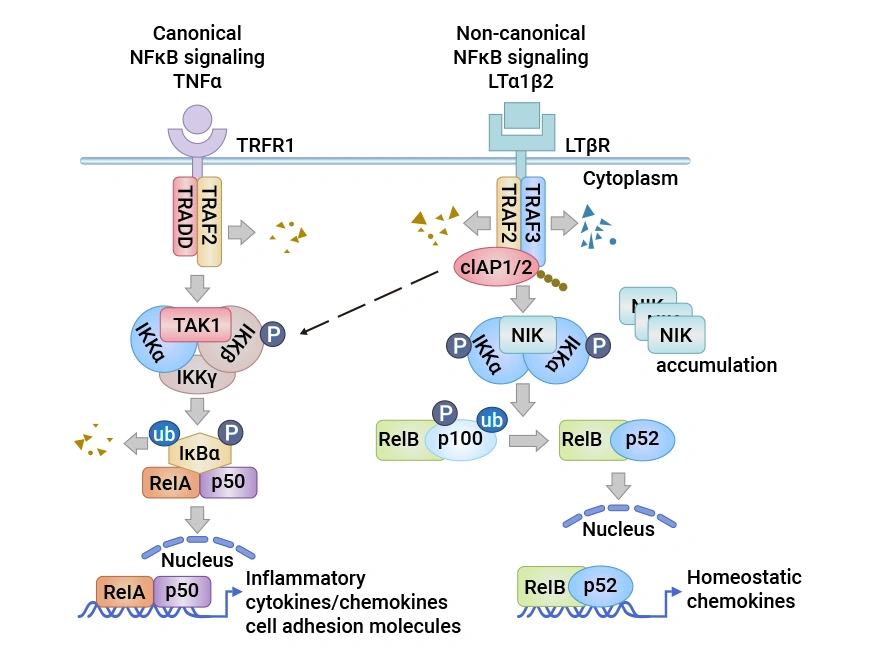
圖2:淋巴管內(nèi)皮細(xì)胞中的淋巴毒素 β 受體(LTβR)信號(hào)通路
圖源:doi:10.3390/cells10040747.[13]
3. LTBR信號(hào)轉(zhuǎn)導(dǎo)路徑
3.1 LTBR的信號(hào)轉(zhuǎn)導(dǎo)機(jī)制
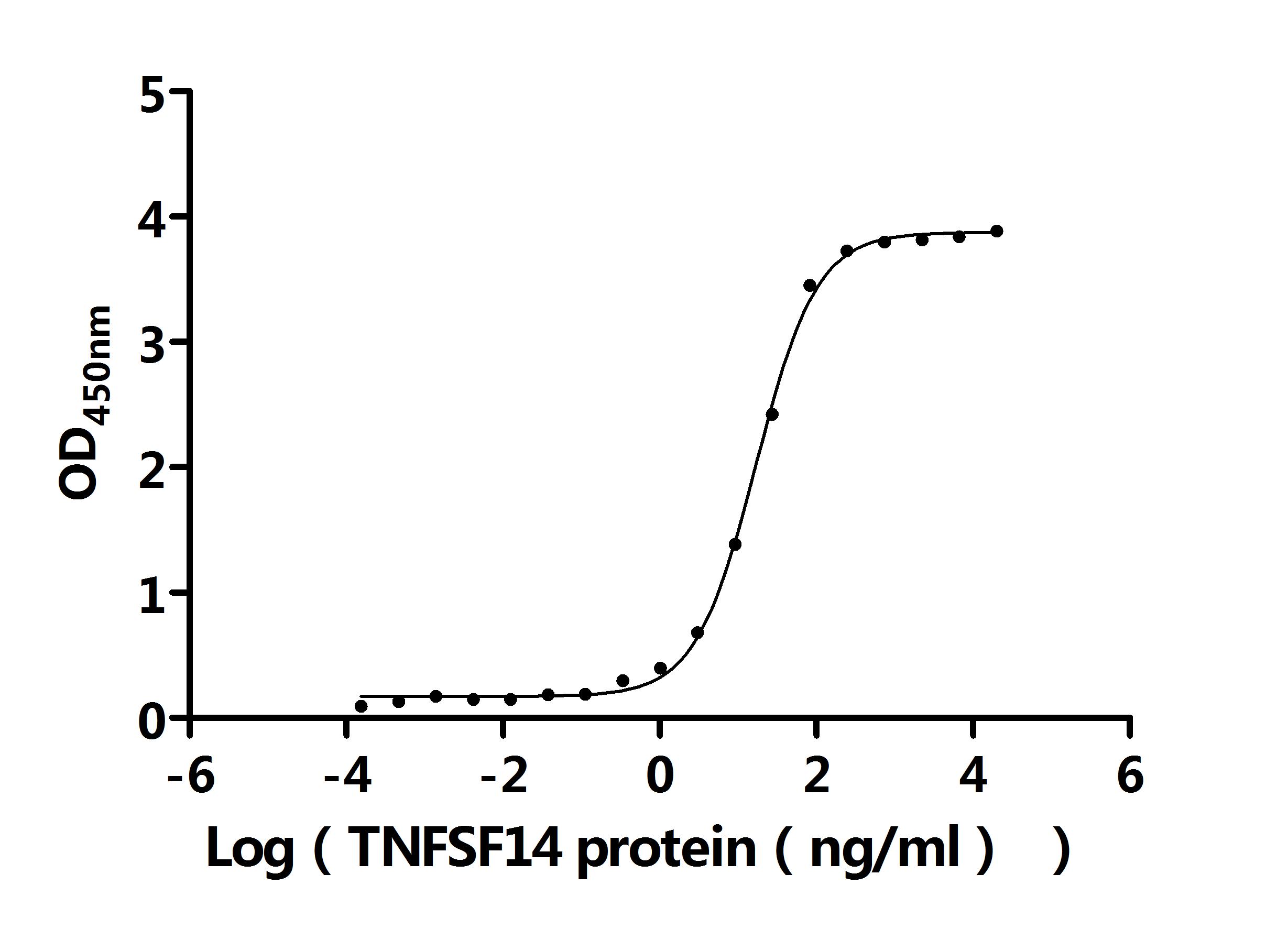
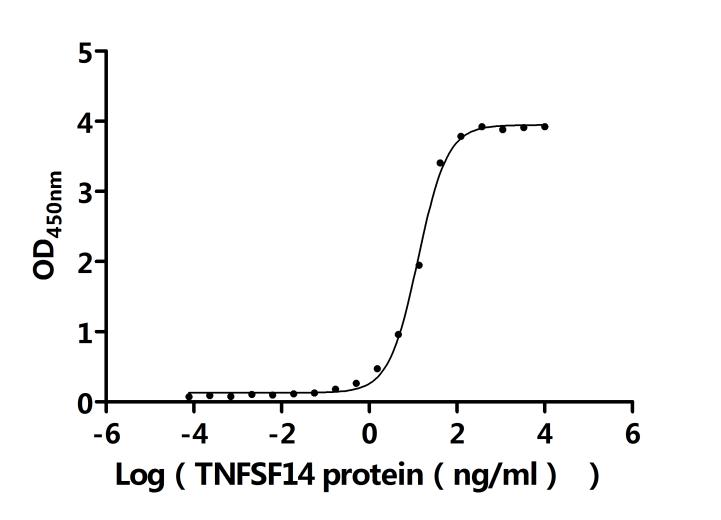
LTBR的信號(hào)傳導(dǎo)具有多效性功能,與配體結(jié)合后會(huì)觸發(fā)一系列復(fù)雜信號(hào)事件。LTBR有兩種天然配體,即LTα1β2和LIGHT(TNFSF14)[11]。LTα1β2是純粹的膜結(jié)合蛋白,由LTβ亞基錨定,僅與LTBR結(jié)合;而LIGHT不僅能與LTBR結(jié)合,還可與HVEM結(jié)合,且存在膜結(jié)合和可溶性?xún)煞N形式。配體與LTBR結(jié)合后,會(huì)啟動(dòng)TRAF2和TRAF3向LTBR復(fù)合物募集 [12]。
3.2 相關(guān)下游信號(hào)通路
在募集過(guò)程中,TRAF2和TRAF3被cIAP1/2降解,進(jìn)而導(dǎo)致NF-κB誘導(dǎo)激酶(NIK)的穩(wěn)定和積累 [13]。NIK與IKKα復(fù)合物被激活,促使同二聚體IKKα磷酸化。最終,與RelB結(jié)合的p100前體被切割成p52,形成的RelB-p52異二聚體復(fù)合體易位到細(xì)胞核,啟動(dòng)趨化因子基因轉(zhuǎn)錄。同時(shí),LTBR連接還激活I(lǐng)KKα/β磷酸化和RelA/p50核易位,引發(fā)炎癥和細(xì)胞粘附分子的基因轉(zhuǎn)錄。這些信號(hào)通路相互協(xié)作,共同調(diào)控細(xì)胞的增殖、存活以及免疫相關(guān)分子的表達(dá)。
3.3 LTBR 在細(xì)胞相互作用中的信號(hào)轉(zhuǎn)導(dǎo)
LTα1β2主要在T細(xì)胞和B細(xì)胞上表達(dá),而T細(xì)胞和B細(xì)胞卻缺乏LTBR的表達(dá),這就形成了一種獨(dú)特的信號(hào)交流模式。這種模式使得LTα1β2-LTBR信號(hào)在淋巴細(xì)胞和LTBR承載細(xì)胞之間的通訊中發(fā)揮著獨(dú)特作用,協(xié)調(diào)著免疫細(xì)胞之間的相互作用和免疫反應(yīng)的強(qiáng)度。例如,在抗原呈遞過(guò)程中,T細(xì)胞通過(guò)表達(dá)LTα1β2與表達(dá)LTBR的抗原呈遞細(xì)胞相互作用,促進(jìn)T細(xì)胞的活化和免疫應(yīng)答的啟動(dòng) [5]。
4. LTBR與免疫調(diào)控
4.1 LTBR在B細(xì)胞活化與增殖中的作用
雖然B細(xì)胞本身不表達(dá)LTBR,但LTBR通過(guò)其信號(hào)傳導(dǎo)對(duì)B細(xì)胞的活化與增殖有著重要影響。它所調(diào)控的細(xì)胞因子和趨化因子等,可以為B細(xì)胞的活化和增殖提供適宜的微環(huán)境,促進(jìn)B細(xì)胞對(duì)抗原的識(shí)別和免疫應(yīng)答 [7]。研究表明,在缺乏LTBR信號(hào)的情況下,B細(xì)胞的活化和抗體產(chǎn)生會(huì)受到明顯抑制,說(shuō)明LTBR在B細(xì)胞免疫應(yīng)答中起著關(guān)鍵的支持作用 [8]。
4.2 LTBR在T細(xì)胞功能調(diào)節(jié)中的影響
LTBR對(duì)T細(xì)胞功能也起到調(diào)節(jié)作用。它可以影響T細(xì)胞的分化方向,調(diào)控T細(xì)胞的活化和增殖,還能調(diào)節(jié)T細(xì)胞分泌細(xì)胞因子,從而在細(xì)胞免疫中發(fā)揮關(guān)鍵的調(diào)節(jié)作用 [9]。在T細(xì)胞分化過(guò)程中,LTBR信號(hào)通路的激活可以促進(jìn)Th1和Th17細(xì)胞的分化,增強(qiáng)細(xì)胞免疫功能 [10]。
4.3 LTBR在抗體生成與免疫記憶中的角色
在抗體生成過(guò)程中,LTBR參與調(diào)節(jié)B細(xì)胞向漿細(xì)胞的分化,促進(jìn)抗體的產(chǎn)生。而且,在免疫記憶的形成和維持中,LTBR也發(fā)揮著作用,幫助免疫系統(tǒng)記住曾經(jīng)入侵的病原體,以便在再次遇到時(shí)能夠迅速做出反應(yīng) [2]。實(shí)驗(yàn)數(shù)據(jù)表明,在免疫記憶形成階段,阻斷LTBR信號(hào)會(huì)導(dǎo)致免疫記憶細(xì)胞的數(shù)量減少和功能受損,影響機(jī)體對(duì)再次感染的抵抗力 [12]。
5. LTBR在疾病中的研究進(jìn)展
5.1 LTBR與自身免疫疾病的關(guān)系
研究發(fā)現(xiàn),LTBR信號(hào)通路與多種自身免疫疾病相關(guān) [4]。在一些自身免疫疾病中,如類(lèi)風(fēng)濕性關(guān)節(jié)炎、系統(tǒng)性紅斑狼瘡等,LTBR信號(hào)通路可能出現(xiàn)異常激活或失調(diào),導(dǎo)致免疫系統(tǒng)錯(cuò)誤地攻擊自身組織,引發(fā)炎癥和組織損傷 [5]。在類(lèi)風(fēng)濕性關(guān)節(jié)炎患者的關(guān)節(jié)滑膜組織中,LTBR的表達(dá)水平明顯升高,其相關(guān)信號(hào)通路的過(guò)度激活促進(jìn)了炎癥細(xì)胞的浸潤(rùn)和炎癥因子的釋放,加劇了關(guān)節(jié)的炎癥和破壞 [6]。
5.2 LTBR在感染性疾病中的作用
在感染性疾病中,LTBR對(duì)機(jī)體抵抗病原體感染起著重要作用。它可以調(diào)節(jié)免疫細(xì)胞的功能,增強(qiáng)機(jī)體對(duì)病原體的清除能力 [7]。然而,某些病原體也可能利用LTBR信號(hào)通路來(lái)逃避免疫監(jiān)視,或者過(guò)度激活免疫反應(yīng),導(dǎo)致免疫病理?yè)p傷 [8]。例如,在病毒感染過(guò)程中,病毒可能通過(guò)干擾LTBR信號(hào)通路,抑制免疫細(xì)胞的活化和功能,從而實(shí)現(xiàn)免疫逃逸 [9]。
5.3 LTBR與腫瘤免疫的相關(guān)性
腫瘤微環(huán)境中,LTBR的作用備受關(guān)注。一方面,激活LTBR信號(hào)通路可以誘導(dǎo)三級(jí)淋巴結(jié)構(gòu)(TLS)的形成 [10]。TLS是免疫細(xì)胞的聚集體,能夠促進(jìn)免疫細(xì)胞流入腫瘤部位,增強(qiáng)機(jī)體的抗腫瘤免疫反應(yīng) [11]。許多研究表明,腫瘤內(nèi)TLS的存在和其數(shù)量、密度與多種癌癥類(lèi)型的良好預(yù)后相關(guān)。在黑色素瘤患者中,腫瘤組織內(nèi)TLS的高浸潤(rùn)與患者的生存期延長(zhǎng)和復(fù)發(fā)率降低相關(guān) [12]。另一方面,腫瘤細(xì)胞也可能通過(guò)調(diào)控LTBR信號(hào)通路來(lái)抑制免疫細(xì)胞的功能,從而實(shí)現(xiàn)免疫逃逸 [13]。一些腫瘤細(xì)胞通過(guò)分泌抑制性細(xì)胞因子,干擾LTBR信號(hào)通路的正常傳導(dǎo),使得免疫細(xì)胞無(wú)法有效識(shí)別和殺傷腫瘤細(xì)胞 [5]。
6. LTBR相關(guān)藥物研發(fā)進(jìn)展
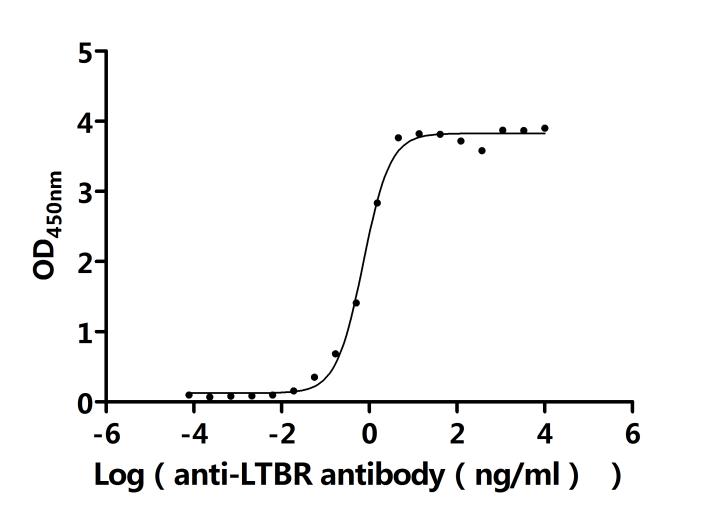
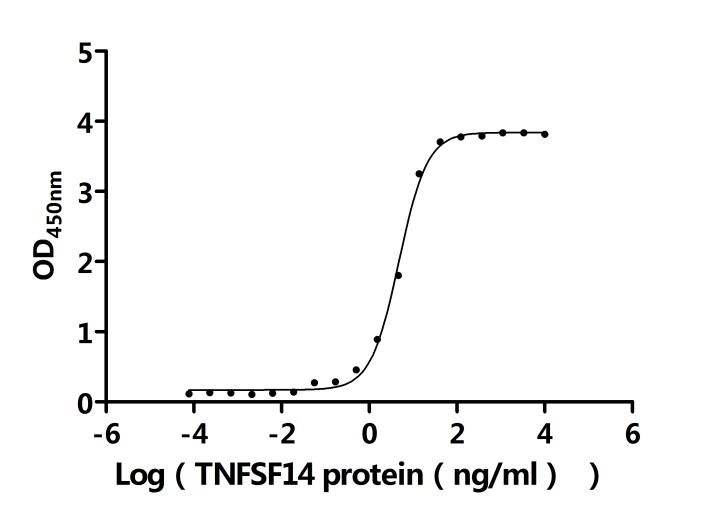
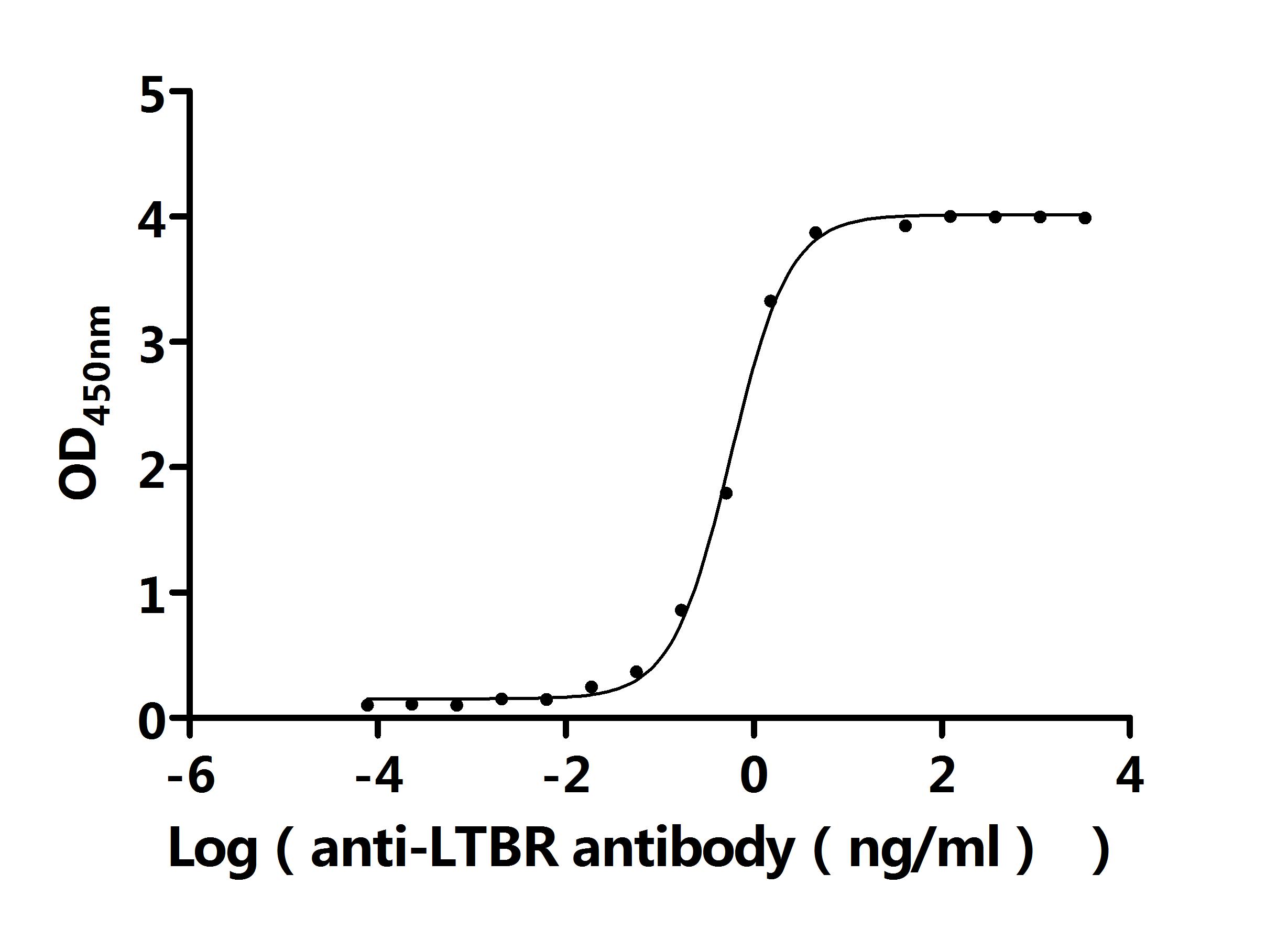
基于LTBR在免疫調(diào)節(jié)和疾病發(fā)生發(fā)展中的重要作用,目前已有多條抗體藥物管線在研,處于臨床前或藥物發(fā)現(xiàn)階段,主要適應(yīng)癥為腫瘤。部分在研藥物列舉如下:
| 藥物 | 藥物類(lèi)型 | 在研適應(yīng)癥(疾病名) | 在研機(jī)構(gòu) | 最高研發(fā)階段 |
|---|---|---|---|---|
| hCBE-11 | 單克隆抗體 | 直腸癌 | Biogen, Inc. | 臨床前 |
| M-300 (Mestag) | 雙特異性抗體 | 實(shí)體瘤 | Mestag Therapeutics Ltd. | 臨床前 |
| CN117377687 | 納米抗體 | 實(shí)體瘤 | Vlaams Instituut voor Biotechnologie - Flanders Institute | Université Catholique de Louvain | Vrije Universiteit Brussel | 藥物發(fā)現(xiàn) |
| WO2024211478 | 細(xì)胞療法 | 腫瘤 | 泌尿生殖系統(tǒng)疾病 | Regeneron Pharmaceuticals, Inc. | 藥物發(fā)現(xiàn) |
7. LTBR研究相關(guān)產(chǎn)品推薦
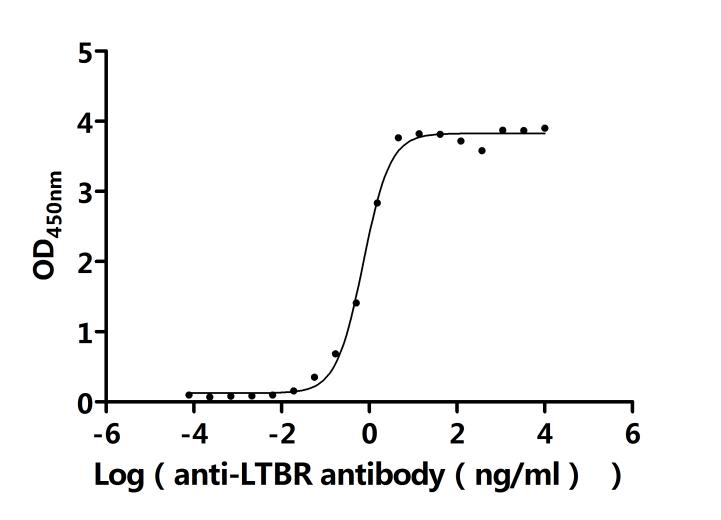
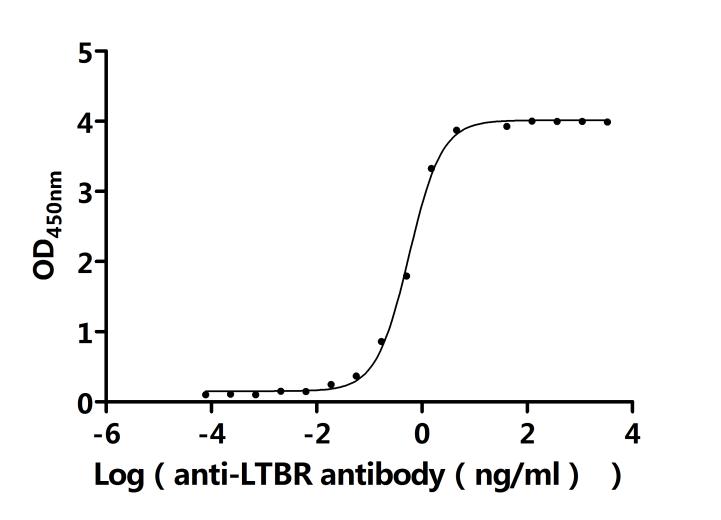
LTBR在細(xì)胞間通訊、免疫反應(yīng)調(diào)節(jié)以及疾病發(fā)生發(fā)展中發(fā)揮著重要作用。為助力各藥企及科研機(jī)構(gòu)研發(fā)人員對(duì)LTBR的研究,華美生物重磅推出多款高活性的LTBR蛋白產(chǎn)品,覆蓋人、小鼠、猴等多種屬,并提供LTBR抗體及ELISA試劑盒產(chǎn)品,助力您在LTBR機(jī)制方面的研究或其潛在臨床價(jià)值的探索。
● LTBR重組蛋白
● LTBR抗體
點(diǎn)擊查看LTBR所有相關(guān)產(chǎn)品
參考文獻(xiàn):
[1] Chen Y, et al. Crystal structure of the lymphotoxin - beta receptor extracellular domain. Structure. 2002;10 (1):109 - 120.
[2] Smith C A, et al. The TNF receptor superfamily of cellular and viral proteins: activation, costimulation, and death. Cell. 1994;76 (6):959 - 962.
[3] Browning J L, et al. Lymphotoxin beta receptor expression and signaling. The Journal of experimental medicine. 1994;180 (4):1473 - 1478.
[4] Cheng G, et al. TRAF2 and TRAF5 mediate NF - kappa B activation by the lymphotoxin beta receptor. Molecular and cellular biology. 1995;15 (12):6709 - 6717.
[5] Ware C F, et al. Lymphotoxin - beta receptor - deficient mice lack peripheral lymph nodes, splenic follicular dendritic cells, and a subset of B cells. Cell. 1996;87 (3):1185 - 1194.
[6] Mebius R E, et al. Lymphotoxin and tumor necrosis factor regulate distinct aspects of early spleen organogenesis. The Journal of experimental medicine. 1998;187 (11):1657 - 1668.
[7] Grewal I S, et al. LIGHT, a new member of the TNF superfamily, and lymphotoxin alpha are ligands for herpesvirus entry mediator. Immunity. 1999;10 (4):435 - 443.
[8] Senftleben U, et al. Activation by IKKalpha of a second, evolutionary conserved, NF - kappaB signalling pathway. Nature. 2000;406 (6798):86 - 90.
[9] Kikly K, et al. Lymphotoxin - beta receptor engagement is required for the development of experimental autoimmune encephalomyelitis. The Journal of experimental medicine. 1999;190 (7):1073 - 1080.
[10] Kerdiles Y M, et al. Inducing tertiary lymphoid structures in tumours using a LIGHT - based fusion protein. Nature. 2015;521 (7553):365 - 369.
[11] Panni R, et al. Systematic analysis of the prognostic value and immunological function of LTBR in human cancer. Aging. 2020;12 (12):11634 - 11653.
[12] Herbst R S, et al. Abstract LB123: Conditionally active, therapeutic lymphotoxin beta receptor (LTBR) agonist bispecific antibodies for induction of tertiary lymphoid structures in the treatment of solid tumors. Cancer Research. 2022;82 (4_Supplement):LB123 - LB123.
[13] Piao W, et al. LTβR Signaling Controls Lymphatic Migration of Immune Cells. Cells. 2021;10 (4):747. doi:10.3390/cells10040747.