DT3C-ADC抗體內化效率體外檢測新工具
日期:2022-03-30 11:17:23
2014年MikiYamaguchi等人通過基因重組技術生產的一種重組蛋白,主要用于體外檢測癌細胞對mAb的內化效率,進而篩選出更有效的單克隆抗體。該蛋白包括一個沒有受體結合域的白喉毒素diphtheria toxin (DT)和鏈球菌蛋白G(Streptococcus protein G)的C1、C2、C3 (3C)結構域,即DT3C。DT3C是繼Mab-ZAP之后檢測細胞內化mAb效率的有效工具,文獻數據顯示,與mAb-Mab-ZAP相比,mAb-DT3C模擬的抗體偶聯藥物( Antibody-Drug Conjugate,ADC)具有易制備、分子量穩定及抗體內化效率高等特點[1]。為了進一步驗證DT3C在ADC抗體藥內化效率檢測中的作用,2015年,MikiYamaguchi等人又利用DT3C作為工具篩選了一種靶向胰腺導管腺癌細胞的anti-Mucin 13單克隆抗體[2]。據不完全統計,目前DT3C作為檢測mAb內化能力的工具已經用于近130項ADC藥物mAb篩選專利中,那DT3C究竟是如何介導ADC藥物mAb內化效率檢測的呢?
1、什么是ADC藥物內化?
在細說DT3C是如何介導ADC藥物mAb內化效率檢測之前,我們先來了解下什么是ADC藥物mAb內化。ADC藥物由抗體、連接子和小分子毒素組成,是通過連接子(linker)將具有生物活性的小分子藥物偶聯至單克隆抗體上。單抗通過腫瘤細胞相關抗原的特異性和靶向性定位到腫瘤細胞表面,并通過內吞/內化作用進入細胞,連接子在細胞內低pH值或溶酶體蛋白作用下斷裂,釋放出具有活性的細胞毒藥物,破壞DNA或阻止腫瘤細胞分裂,從而對腫瘤細胞起到殺傷作用。該類藥物利用抗體的特異性靶向運輸藥物分子到靶組織發揮作用,將細胞毒藥物強大的細胞殺傷能力集中于腫瘤細胞,降低對正常組織的毒副作用。在ADC設計研發過程中,首要的是藥物靶點的選擇。對于藥物靶點的選擇,除了要在腫瘤過度表達外,另一個重要因素是內吞/內化的效率,這是藥物釋放活性所必需的。抗體能否被內化主要由靶點決定,而抗體內化的效率則與抗原密度、抗體親和力以及抗體與抗原結合表位密切相關。同一靶點的不同抗體也會表現出不同的內化效率。
2、DT3C如何介導ADC抗體藥物內化效率體外檢測?
如前所述,ADC藥物中抗體能否被內化是藥物效果評價的重要因素。這里你可能會疑問,ADC藥物中抗體的內化與單純的抗體藥物內化有區別嗎?為什么DT3C是專門針對的ADC藥物呢?首先,ADC藥物中抗體的內化與單純的抗體藥物內化肯定是有區別,首先ADC藥物的分子量是大于單純的抗體藥物的,相同條件下,二者的內化效率肯定是不一樣的。其次,DT3C替代的是ADC藥物分子中的小分子藥物,是一種免疫毒素,mAb-DT3C偶聯物模擬的是ADC藥物。如下圖所示:mAb-DT3C偶聯復合物識別并結合細胞表面抗原后,mAb-DT3C-抗原復合物被內化;然后DT3C被胞質弗林蛋白酶(furin protease)切割,DT3C的催化結構域被釋放到細胞質中。DT3C的催化結構域導致延伸因子(EF)-2的 ADP-核糖基化,隨后通過抑制蛋白質翻譯機制導致細胞毒性。
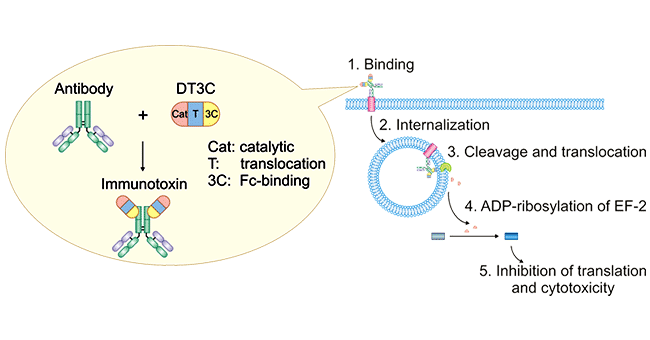
圖1. Mechanism of antibody:DT3C-induced cytotoxicity
作為ADC藥物抗體內化檢測工具,DT3C優勢可總結為以下三點:
第一,mAb-DT3C偶聯物制備簡單,僅在室溫下孵育30min就能形成,而且在體外可以發揮患者給ADC藥物后的功能;
第二,DT3C可與來自不同物種(如人、小鼠、兔、山羊)的任何 IgG 結合,形成 mAb-DT3C 偶聯物,從而進一步擴大了DT3C作為mAb抗體內化檢測工具的范圍;
第三,只有當偶聯物被靶細胞內化時,mAb-DT3C 偶聯物才會顯著降低細胞活力。
值得一提的是,在DT3C之前,Mab-ZAP是唯一能夠檢測細胞內化mAb 效率工具。 Mab-ZAP由小鼠抗體和核糖體失活蛋白皂草素組成。當 mAb-Mab-ZAP 偶聯物被細胞內化時,由于皂草素的毒性,細胞會發生凋亡。所以可以通過細胞的存活率來檢測mAb是否被細胞內化。但是,不能排除Mab-ZAP本身在一定程度上可能降低mAb內化效率,因為 Mab-ZAP是一種包含抗小鼠抗體的大分子。與Mab-ZAP相比,mAb-DT3C偶聯物的分子量穩定且小于mAb-Mab-ZAP。并且,相關實驗數據表明,mAb-DT3C內化效率高于mAb-Mab-ZAP。
3、ADC藥物內化途徑
目前,關于mAb-DT3C復合物內化的具體途徑暫無相關文獻報道。結合常規的ADC藥物內化途徑,一般來說,內化又稱為內吞,正常的內吞作用可分為三個階段:芽的形成、膜的彎曲和囊泡的成熟和膜的斷裂并釋放到細胞質中。ADC藥物內化途徑可按是否依賴于網格蛋白分為:網格蛋白介導的內吞作用和非網格蛋白介導的內吞作用。非網格蛋白介導的內吞作用又可進一步分為:小窩介導的內吞作用、小窩蛋白非依賴性載體蛋白/GPI-富集的早期內區室(CLIC/GEEC)和巨胞飲作用。多種內吞途徑有重疊的方面,因此內吞的過程一般是高度靈活和復雜的。這里以小窩介導的內吞作用為例:
網格蛋白介導的內吞作用(CME)包括幾個連續和部分重疊的步驟。對于質膜上的一些受體而言,CME可以組成型發生;其他受體則需要配體或抗體結合后啟動。當細胞質中的內吞衣殼蛋白開始聚集在質膜的內小葉上時,CME就開始了。衣殼蛋白通過從細胞質中招募并與額外的蛋白質接頭并相互作用,繼續組裝和生長。關鍵的銜接蛋白使膜彎曲,從而將內化受體/配體集中到一個“網格蛋白包被坑”(CCP)中。在CCP頸部因CCP內陷變大而收縮的點處會通過斷裂與質膜分離。肌動蛋白聚合有助于將CCP “向內”拉入細胞質,直到完全分裂,CCP 被釋放并變成網格蛋白包被的囊泡 (CCV)。最后,CCV外殼解體,CCV與內體融合,分揀到確定的亞細胞位置,或者可以循環回細胞表面 [3]。
參考文獻:
[1] Yamaguchi M, Nishii Y, Nakamura K, et al. Development of a sensitive screening method for selecting monoclonal antibodies to be internalized by cells [J]. Biochem Biophys Res Commun. 2014: 454(4):600-3.
[2] Nishii Y, Yamaguchi M, Kimura Y, et al. A newly developed anti-Mucin 13 monoclonal antibody targets pancreatic ductal adenocarcinoma cells [J]. Int J Oncol. 2015, 46(4):1781-7.
[3] Hammood M, Craig AW, Leyton JV. Impact of Endocytosis Mechanisms for the Receptors Targeted by the Currently Approved Antibody-Drug Conjugates (ADCs)-A Necessity for Future ADC Research and Development [J]. Pharmaceuticals (Basel). 2021 Jul 15;14(7):674.










