Western Blot
對(duì)于任何一個(gè)科研菌都不陌生。
BUT
為甚么別人的實(shí)驗(yàn),時(shí)間短跑膠快?
除了實(shí)驗(yàn)精細(xì)化操作,
當(dāng)然也離不開(kāi)選擇最佳的試劑,
和對(duì)關(guān)鍵實(shí)驗(yàn)步驟的優(yōu)化設(shè)計(jì)。
科研就像賽跑,你比別人跑的快,就比別人多發(fā)幾篇SCI~
陽(yáng)春三月,咱們從WB說(shuō)起……
蛋白免疫印跡(WB)是基于抗原抗體的特異性結(jié)合作用,以檢測(cè)復(fù)雜樣品中的某種蛋白,并對(duì)其進(jìn)行半定量分析的一種方法。
主要用于靶標(biāo)蛋白特異性表達(dá)的定性或半定量分析,蛋白與蛋白或蛋白與DNA相互作用的后續(xù)分析,以及蛋白修飾的鑒定分析。
1.1 蛋白樣品來(lái)源
用于WB的蛋白樣本可以是可溶性蛋白液,細(xì)胞組織裂解液,及免疫沉淀蛋白。對(duì)于不同樣品蛋白上樣量存在區(qū)別,純蛋白建議不超過(guò)100 ng,細(xì)胞組織裂解液10-40 μg。
1.2 蛋白樣品制備
一般從動(dòng)植物組織或細(xì)胞中提取復(fù)雜蛋白成分,在提取過(guò)程中應(yīng)遵守如下原則:
① 結(jié)合蛋白特性采用合適的提取方法;
② 采用合適的方法最大限度提取靶標(biāo)蛋白;
③ 保持低溫操作,并加入蛋白酶抑制劑,防止蛋白降解;
④ 選擇合適的蛋白裂解液,以維持蛋白可溶性狀態(tài);
⑤ 蛋白樣品-80℃低溫保存或變性后保存,避免反復(fù)凍融,并盡快檢測(cè)。
✪ 細(xì)胞樣本蛋白制備
➥待細(xì)胞匯合度達(dá)到80%,取出培養(yǎng)皿(10 cm),此時(shí)細(xì)胞生長(zhǎng)至對(duì)數(shù)期,活性良好。棄去培養(yǎng)液,加入預(yù)冷的PBS緩沖液洗滌3次,置于冰上。
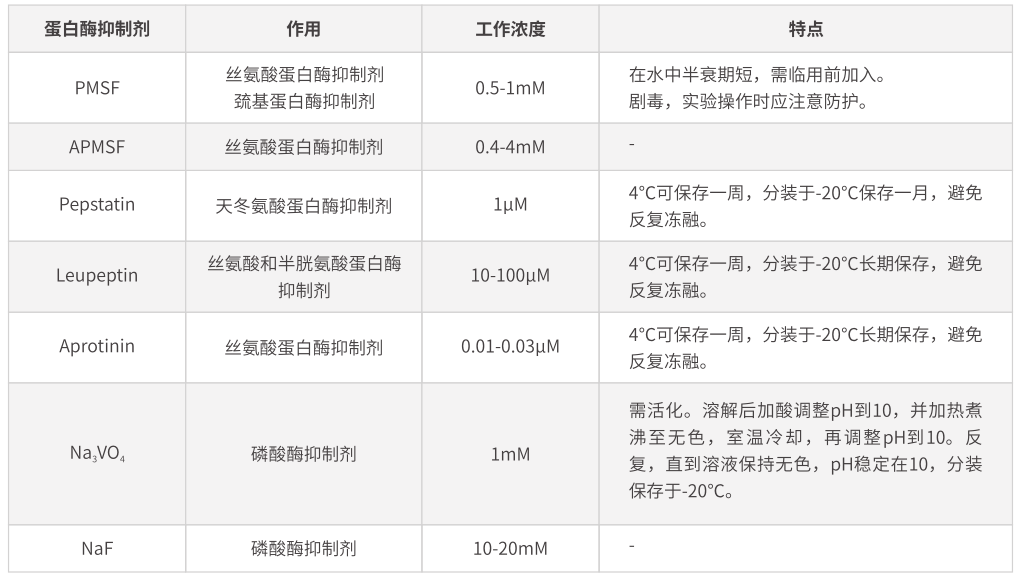
➥配制含蛋白酶抑制劑的裂解液,常用蛋白酶抑制劑見(jiàn)下表,需根據(jù)實(shí)驗(yàn)要求選擇合適的蛋白酶抑制劑。最常用的蛋白酶抑制劑為PMSF(工作濃度1 mM),劇毒,使用時(shí)應(yīng)注意自我防護(hù),其在水中半衰期極短,故在臨用前加入。
➥加入1 mL含蛋白酶抑制劑的蛋白裂解液于10 cm培養(yǎng)皿中,輕輕晃勻后,置于冰上裂解15-30 min。
➥用干凈的細(xì)胞刮迅速刮取細(xì)胞于一側(cè),并將含細(xì)胞碎片的裂解液轉(zhuǎn)移至1.5 mLEp管中,置于冰上。此時(shí)應(yīng)避免氣泡產(chǎn)生。
注:收集的細(xì)胞亦可通過(guò)超聲破碎進(jìn)行充分裂解。將超聲探頭置于樣本裂解液中部,但不觸碰管壁或管底,進(jìn)行超聲。
➥于4℃,12000 rpm離心10-15 min。
➥輕輕取出EP管,用槍頭吸去上層上清于新的EP管中,注意不要吸到上層漂浮的脂質(zhì)等雜質(zhì),并置于冰上備用。
➥經(jīng)蛋白定量后,加入適量6×Sample loading buffer 95℃煮樣5 min,12000 rpm離心30 s,-20℃保存。
✪ 組織樣本蛋白制備
➥獲取新鮮組織樣本,并用生理鹽水或PBS洗滌干凈,用潔凈的剪刀將組織剪碎至合適大小。可采用1-2 mL勻漿器置于冰上進(jìn)行組織勻漿,或加入液氮進(jìn)行研磨。因組織塊相對(duì)不易破壞,且在勻漿過(guò)程中存在摩擦產(chǎn)熱,推薦采用液氮研磨。
➥配制含蛋白酶抑制劑的裂解液。
➥加入適量含蛋白酶抑制劑的裂解液(50 mg/500 μL)于研磨后的組織樣本中,將離心管置于冰上裂解15-30 min,期間進(jìn)行間斷混勻,以充分裂解。
注:為確保組織細(xì)胞充分裂解,建議進(jìn)行超聲破碎。調(diào)節(jié)超聲儀至適宜頻率與功率(超聲功率不宜過(guò)大,并設(shè)置超聲間歇,以防止超聲探頭過(guò)度產(chǎn)熱),將超聲探頭置于樣本裂解液中部,但不觸碰管壁或管底,進(jìn)行冰浴超聲。
➥于4℃,12000 rpm離心10-15 min。
➥輕輕取出EP管,用槍頭吸去上層上清于新的EP管中,注意不要吸到上層漂浮的脂質(zhì)等雜質(zhì),并置于冰上備用。
➥經(jīng)蛋白定量后,加入適量的6×Sample loading buffer 95℃煮樣,12000 rpm離心30 s,-20℃保存。
1.3 蛋白裂解液的選擇
蛋白裂解液的主要成分及其作用如下:
1. 緩沖體系
一定pH范圍的緩沖體系,為蛋白提供了一個(gè)穩(wěn)定環(huán)境,并增加蛋白溶解度。常用近似生理pH狀態(tài)的Tris-HCl或HEPES緩沖體系,pH7.4。Tris-HCl(pKa=8.1)pH緩沖范圍為7.0-9.2,其對(duì)溫度較為敏感。HEPES(pKa=7.55)pH緩沖范圍為6.5-8.5。
2. 鹽離子
在適當(dāng)鹽離子濃度下,保持蛋白溶解狀態(tài)。選擇近似生理狀態(tài)下的150 mM的NaCl,不會(huì)對(duì)破壞蛋白以及蛋白間相互作用產(chǎn)生影響。
3. 螯合劑
螯合金屬離子,以防止蛋白提取物過(guò)于黏稠,導(dǎo)致溶解度下降。另外,螯合劑亦可與某些酶發(fā)生相互作用,以抑制酶活性。
4. 還原劑
加入一定量的還原劑保護(hù)蛋白質(zhì)上自由的巰基不被氧化,從而避免蛋白質(zhì)的聚集或變性。常用β-巰基乙醇或二硫蘇糖醇(DTT),后者還原能力強(qiáng)于前者。β-巰基乙醇具有揮發(fā)性,加入緩沖液中以后較短時(shí)間內(nèi)會(huì)被氧化,會(huì)對(duì)蛋白活性產(chǎn)生影響,其使用濃度為5-20 mM/L。而DTT具有更強(qiáng)的還原能力,且在氧化以后能夠形成穩(wěn)定的分子內(nèi)二硫鍵,不會(huì)影響蛋白巰基,使用濃度相對(duì)偏低為0.5-1 mM/L。長(zhǎng)期保存建議使用DTT,但DTT溶液不穩(wěn)定,需要現(xiàn)配現(xiàn)用。
5. 去垢劑
去垢劑即表面活性劑,其通過(guò)分子結(jié)構(gòu)特征,表面活性劑分子的疏水段插入膜的磷脂雙分子層,而改變其通透性,最終破壞膜結(jié)構(gòu)。因此,表面活性劑的強(qiáng)度直接決定了裂解細(xì)胞的強(qiáng)度。裂解液中所使用的表面活性劑主要可分為兩大類:陰離子型表面活性劑和非離子型表面活性劑。常用表面活性劑如下:
十二烷基硫酸鈉(SDS):陰離子表面活性劑,具有很強(qiáng)的破壞力,基本可以使所有的蛋白溶解,并破壞其天然構(gòu)象結(jié)構(gòu)。SDS與蛋白分子以1.4:1的比例進(jìn)行結(jié)合,可以有效的覆蓋蛋白本身所帶的電荷情況。SDS的臨界膠束溫度較高,在低溫時(shí)即會(huì)發(fā)生沉淀,且在鉀鹽存在時(shí),沉淀效果會(huì)更明顯。另外溶液離子強(qiáng)度越強(qiáng),會(huì)降低離子型去污劑的臨界膠束濃度,使得這種蛋白溶解效果更強(qiáng)。
脫氧膽酸鈉(NaDOC):也是一種離子型表面活性劑,作用較SDS弱。
Triton X-100:是一種非離子型表面活性劑。可以破壞蛋白質(zhì)與脂質(zhì)間的相互作用,但并不使蛋白變性,也不破壞蛋白與蛋白間的連接,能夠保留蛋白質(zhì)的天然構(gòu)象。其具有較低的臨界膠束濃度,在64℃下,可觀察到兩相分離。
NP-40:非離子型表面活性劑,對(duì)核膜的破壞作用較弱,與蛋白結(jié)合力強(qiáng),可確保蛋白的充分溶解和結(jié)構(gòu)穩(wěn)定,特別適用于膜蛋白非變形條件下的溶解。
Tween 20:溫和非離子型表面活性劑,蛋白溶解能力較弱,也不會(huì)破壞蛋白結(jié)構(gòu),并不作為蛋白裂解液的常見(jiàn)成分。
去污劑的選擇取決于所要提取蛋白的性質(zhì)與實(shí)驗(yàn)?zāi)康摹P枰浞至呀饧?xì)胞,并溶解蛋白,對(duì)于提取后蛋白的狀態(tài)(變性還是保留天然狀態(tài))都是需要考慮的問(wèn)題。
6. 蛋白酶抑制劑
由于在蛋白提取過(guò)程中,細(xì)胞和組織被破壞,大量蛋白酶被釋放。除了保持在低溫條件下操作以抑制蛋白酶活性外,還應(yīng)加入適量蛋白酶抑制劑以抑制蛋白酶的活性,防止目的蛋白的降解。常用蛋白酶抑制劑如下表:
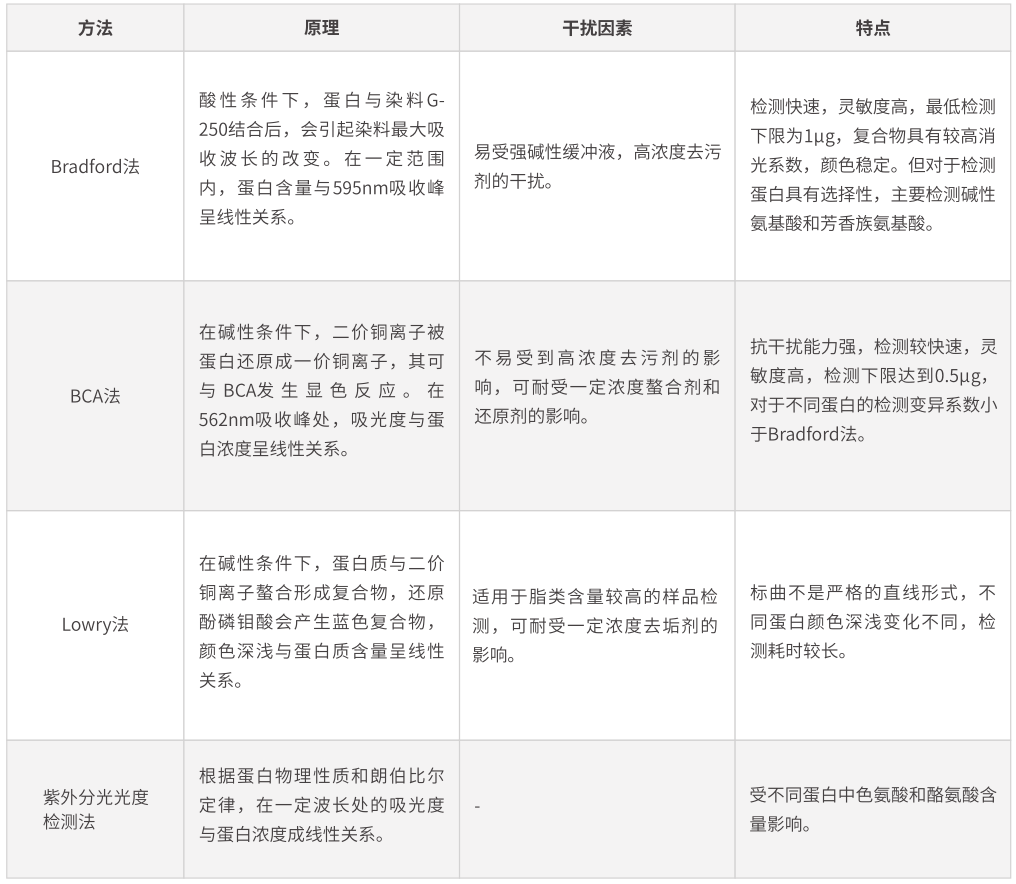
為了對(duì)樣品中的目的蛋白進(jìn)行相對(duì)定量,需要對(duì)樣品間的總蛋白量進(jìn)行檢測(cè)。在總蛋白含量一定的情況下,體現(xiàn)目的蛋白的表達(dá)差異。常用化學(xué)定量方法如下:
最常使用的蛋白定量方法是BCA法和Bradford法。但當(dāng)所使用裂解液中含有高濃度去垢劑時(shí),推薦使用BCA法定量蛋白。
2.1 Bradford法標(biāo)準(zhǔn)曲線的繪制
1.標(biāo)準(zhǔn)蛋白質(zhì)溶液配制:
10 mg/mL牛血清白蛋白(BSA)標(biāo)準(zhǔn)品。準(zhǔn)確稱取0.05 g牛血清白蛋白,溶于5 mL PBS中,即為10 mg/mL牛血清白蛋白。
2.考馬斯亮藍(lán)G-250染色液配制:
稱取50 mg考馬斯亮藍(lán)G-250,溶于25 mL 90%乙醇中,加入85%的磷酸50 mL,最后用純水定容到500 mL,考馬斯亮藍(lán)染色液需避光保存。
3.稀釋待測(cè)蛋白:
將蛋白稀釋三種不同梯度的濃度10倍,20倍,40倍。
4.稀釋標(biāo)曲:
將標(biāo)準(zhǔn)品稀釋8種不同濃度梯度:
| 濃度梯度 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
| 濃度(mg/mL) |
0 |
0.05 |
0.075 |
0.1 |
0.15 |
0.2 |
0.3 |
0.4 |
5.將稀釋好的標(biāo)曲和樣品各取20 μL按順序依次加入到酶標(biāo)孔條中,然后再依次加入G250染色液180 μL,混勻。
6.在酶標(biāo)儀595 nm處測(cè)定吸光值,根據(jù)吸光值做出標(biāo)準(zhǔn)曲線,并根據(jù)標(biāo)準(zhǔn)曲線計(jì)算蛋白濃度。
2.2 BCA檢測(cè)法
1.根據(jù)蛋白數(shù)量,按50:1(V/V)的BCA試劑A與B配置BCA工作液,室溫24 h內(nèi)穩(wěn)定;
2.溶解標(biāo)準(zhǔn)品,使終濃度為0.5 mg/mL。所用溶劑與樣品所用溶劑相同;
3.將標(biāo)準(zhǔn)品按照0,1,2,4,8,12,16,20 μL體積加入到酶標(biāo)板中,并加標(biāo)準(zhǔn)品稀釋液補(bǔ)足到20 μL;
4.向個(gè)孔中加入200 μL BCA工作液,于37℃放置30 min;
5.酶標(biāo)儀檢測(cè)562 nm處吸光度值;
6.根據(jù)繪制的標(biāo)準(zhǔn)曲線計(jì)算出樣品蛋白濃度。
3.1 蛋白樣品制備
變性蛋白,破壞蛋白三級(jí)結(jié)構(gòu),暴露抗原表位,便于抗體結(jié)合與后續(xù)檢測(cè)。將定量后的蛋白加入等體積2×Sample loading buffer 或1/5體積6×Sample loading buffer,于95℃加熱煮沸5 min。
對(duì)于膜蛋白,由于高溫會(huì)使得其聚集沉淀,在37℃處理30 min即可。
6×Sample loading buffer 配方如下:
6%Tris(pH6.8)(V/V)
4%SDS(W/V)
0.2%溴汾藍(lán)(W/V)
20%甘油(V/V)
9%DTT(V/V)
● 注意事項(xiàng):
蛋白溶液上樣量以10-40 μg/孔為宜,避免上樣量超載,造成拖尾。
本期給大家?guī)?lái)WB前三節(jié)的介紹
~下期干貨繼續(xù)噢~
1.蛋白樣品準(zhǔn)備
2.蛋白定量
3.上樣
4.凝膠電泳
5.轉(zhuǎn)膜
6.封閉
7.孵育一抗
8.孵育二抗
9.顯影
10.常見(jiàn)問(wèn)題
—未完·待續(xù)—
——華美生物·讓科研變得有溫度!——
掃碼關(guān)注“武漢華美生物”官方微信
后臺(tái)回復(fù)【實(shí)驗(yàn)技術(shù)WB】
免費(fèi)下載實(shí)驗(yàn)手冊(cè),精彩內(nèi)容搶先掌握!