前沿靶點速遞:每周醫學研究精選(七)
日期:2024-08-07 10:47:57
靶點:OTUD3
應用:肝癌靶點研究
來源:Deubiquitylase OTUD3 regulates integrated stress response to suppress progression and sorafenib resistance of liver cancer. Cell Reports (2024).

張令強團隊在《Cell Reports》雜志上發表的研究成果顯示,去泛素化酶OTUD3通過去除真核起始因子2α(eIF2α)的K27型泛素化修飾,有效抑制了肝癌細胞中的整合應激反應(ISR)激活,進而抑制肝癌的進展和對索拉非尼的耐藥性。研究發現,在小鼠模型中OTUD3的缺失會導致ISR激活增強和肝細胞癌進展加速。臨床肝癌組織中OTUD3表達的減少與ISR激活增強和不良預后顯著相關。此外,癌細胞通過降低OTUD3表達來激活ISR,從而抵抗索拉非尼的藥物治療,而聯合使用ISR抑制劑ISRIB能顯著提高肝癌細胞對索拉非尼的敏感性。這項研究不僅揭示了ISR通路調控的新機制,而且為肝癌治療提供了新的策略,即通過聯合使用ISR抑制劑來克服索拉非尼耐藥性,為肝癌患者帶來新的希望。
靶點:LILRB1
應用:結核病研究
來源:LILRB1-HLA-G axis defines a checkpoint driving natural killer cell exhaustion in tuberculosis. EMBO Molecular Medicine (2024).

中國科學院微生物研究所劉翠華團隊在《EMBO Molecular Medicine》上發表的研究文章《LILRB1–HLA-G axis defines a checkpoint driving natural killer cell exhaustion in tuberculosis》揭示了結核分枝桿菌(M. tuberculosis, Mtb)慢性感染導致自然殺傷(NK)細胞功能耗竭的新機制。研究發現,在Mtb感染過程中,NK細胞表面的抑制性受體LILRB1表達上調,與巨噬細胞分泌的HLA-G分子結合,激活下游的酪氨酸磷酸酶SHP1/2,抑制MAPK信號通路,損害NK細胞的殺傷活性。通過人源化小鼠模型的實驗,研究團隊證明阻斷LILRB1與HLA-G的結合可以增強宿主NK細胞的抗Mtb感染能力,為開發基于宿主的TB免疫治療新手段提供了潛在靶點。該研究由汪靜研究員、高福院士和逄宇教授共同參與,為理解固有免疫細胞在結核病中的免疫活性及其調控機制提供了新的視角,對改善TB患者的免疫治療具有重要意義。
靶點:STING
應用:神經元的炎性損傷研究
來源:STING orchestrates the neuronal inflammatory stress response in multiple sclerosis. Cell (2024).
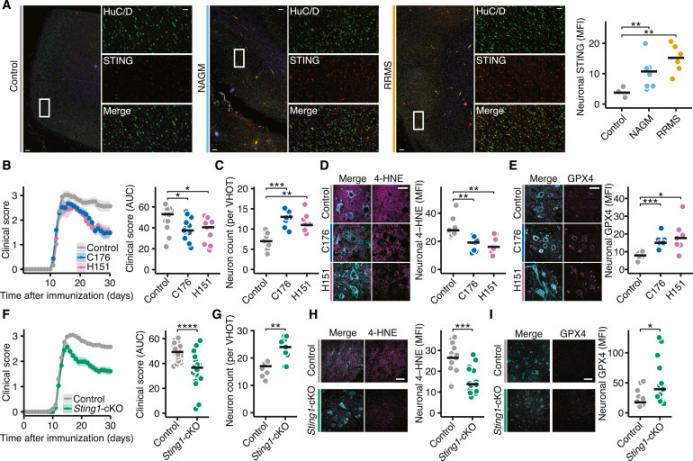
德國漢堡-埃彭多夫大學醫學中心Manuel A. Friese領導的研究團隊在《Cell》雜志上發表的研究發現STING蛋白在多發性硬化癥(MS)中扮演了核心調節者的角色。研究指出STING通過一種不依賴于cGAS和干擾素(IFN)的機制,整合了干擾素和谷氨酸信號,促進了自噬介導的GPX4降解,進而引發鐵死亡。這一發現為理解MS中的神經炎癥反應提供了新的視角,并可能有助于開發針對神經退行性病變的新治療策略。實驗中,STIM1的缺失導致神經元對炎癥相關神經退行性損傷的敏感性增加,而STING抑制劑的使用顯著降低了實驗性自身免疫性腦脊髓炎(EAE)模型中小鼠的神經元損傷,提高了GPX4水平,降低了自噬標志物LC3B的表達以及鐵死亡的發生,從而改善了神經元的炎性損傷。這些結果表明STING可能是治療MS相關神經退行性疾病的一個有前景的新靶點。
靶點:TWIST
應用:克羅恩病引起的腸纖維化研究
來源:TWIST1+ FAP+ fibroblasts in the pathogenesis of intestinal fibrosis in Crohn’s disease. The Journal of Clinical Investigation (2024).

上海交通大學醫學院附屬瑞金醫院鄒多武教授團隊聯合上海市免疫學研究所蘇冰教授團隊在《The Journal of Clinical Investigation》上發表的研究揭示了克羅恩病腸纖維化的關鍵致病機制。研究團隊通過單細胞轉錄組測序技術構建了克羅恩病腸道纖維化的單細胞病理圖譜,發現腸道間質細胞在腸纖維化中起著核心作用,特別是FAP+成纖維細胞亞群,它們在纖維化部位顯著增多,是導致細胞外基質(ECM)過量沉積的主要細胞類型。進一步分析表明,轉錄因子TWIST1在FAP+成纖維細胞的形成和激活中發揮關鍵作用,而腸道CXCL9+巨噬細胞通過分泌IL-1β和TGF-β等細胞因子促進了TWIST1的表達。在小鼠模型中,通過特異性敲除TWIST1或使用TWIST1抑制劑Harmine,可以顯著改善腸纖維化。這些發現不僅為理解克羅恩病腸纖維化的病理過程提供了新的視角,也為開發新的治療策略提供了潛在的靶點,具有重要的臨床意義和應用前景。
靶點:PKM2
應用:抗衰老靶點研究
來源:PKM2 aggregation drives metabolism reprograming during aging process. Nature Communications (2024).

北京大學基礎醫學院的羅建沅教授團隊與李婷婷教授、劉小云研究員、陳軍副教授合作,在衰老生物學領域取得了重要進展。他們的研究團隊在《Nature Communications》上發表的研究論文指出,在衰老過程中,M2亞型丙酮酸激酶PKM2會發生異常聚集,這一現象對PKM2的酶活性和糖酵解通路產生了抑制作用,從而加速了衰老表型的出現。更為重要的是,該團隊通過高通量篩選技術,成功鑒定出兩種小分子化合物K35和K27,這些化合物能夠有效地抑制PKM2的聚集。在細胞和小鼠模型中的實驗顯示,這兩種化合物不僅能夠延緩細胞衰老,還能顯著恢復衰老小鼠的生理功能,并延長它們的壽命。這項研究的意義在于,它不僅首次揭示了PKM2聚集在衰老進程中的調控作用,而且為抗衰老藥物的開發提供了新的靶點。
靶點:KEAP1
應用:乳腺癌治療靶點
來源:Tumor suppressor KEAP1 promotes HSPA9 degradation, controlling mitochondrial biogenesis in breast cancer. Cell Reports (2024).

哈爾濱醫科大學的胡晶教授、李水潔教授和陳雪松教授的研究團隊在《Cell Reports》上發表的研究揭示了腫瘤抑制因子KEAP1在乳腺癌中調控線粒體生物發生的新機制。研究顯示,KEAP1與患者的預后呈正相關,并通過調節HSPA9的泛素化和降解來影響線粒體的生物發生和氧化磷酸化,這在乳腺癌細胞的增殖、凋亡和細胞周期轉變中起著至關重要的作用。作為細胞代謝的關鍵調控因子,KEAP1的這一新功能可能對乳腺癌的發生和發展產生顯著影響。研究還觀察到乳腺癌組織中線粒體相關蛋白表達的升高,強調了線粒體生物發生對維持線粒體穩定性的重要性。KEAP1通過負調控線粒體蛋白合成和氧化磷酸化,展現了其在乳腺癌線粒體生物發生中的新角色,為乳腺癌治療提供了潛在的生物標志物和治療靶點。
靶點:CCN3
應用:骨質疏松癥等骨骼疾病
來源:A maternal brain hormone that builds bone. Nature (2024).

加州大學的研究團隊在《Nature》期刊上發表了一項重要研究成果,他們發現了一種名為CCN3的新激素,被命名為“母體腦激素”(MBH)。這種激素能在哺乳期顯著提高女性的骨密度和骨強度,即使在大量鈣質轉移至乳汁中的情況下也不例外。CCN3不僅能幫助維持哺乳期婦女的骨骼健康,還展現出促進骨折愈合的潛力,并且能夠在較低的雌激素水平下促進骨骼干細胞分化和新骨細胞生成,從而增加骨量。這些特性表明CCN3可能成為治療骨質疏松癥等骨骼疾病的新方法。研究人員還開發出一種能夠緩慢釋放CCN3的水凝膠貼片,這種貼片在實驗中成功加速了老年小鼠骨折部位的愈合過程,凸顯了CCN3在臨床應用上的巨大潛力。
靶點:MARK2/3
應用:腫瘤研究
來源:MARK2/MARK3 kinases are catalytic co-dependencies of YAP/TAZ in human cancer. Cancer Discovery (2024).

冷泉港實驗室的Christopher R. Vakoc團隊在《Cancer Discovery》雜志上發表的研究中,發現了一種新的癌癥治療策略,即靶向MARK2/3激酶來抑制YAP/TAZ依賴性腫瘤的生長。通過CRISPR篩選,研究團隊確定了MARK2/3激酶對含有激活型YAP/TAZ的癌細胞系至關重要,并開發了一種MARK抑制肽(MKI),該肽模擬幽門螺桿菌CagA蛋白的EPIYA重復域,能有效抑制MARK激酶活性。在多種癌細胞系中,特別是胰腺癌和乳腺癌,MARK2/3的缺失顯著降低了YAP/TAZ的核轉移和致癌作用,而MKI的表達顯著抑制了腫瘤生長。這項研究不僅揭示了MARK2/3激酶在YAP/TAZ依賴性癌癥中的關鍵作用,而且為開發新的抗癌藥物提供了有希望的靶點,可能有助于克服現有治療方法中的耐藥性問題,為癌癥患者帶來新的治療選擇。
參考文獻
1. Dai, Hongmiao, et al. "Deubiquitylase OTUD3 regulates integrated stress response to suppress progression and sorafenib resistance of liver cancer." Cell Reports 43.7 (2024).
2. Wang, Jing, et al. "LILRB1-HLA-G axis defines a checkpoint driving natural killer cell exhaustion in tuberculosis." EMBO Molecular Medicine (2024): 1-36.
3. Woo, Marcel S., et al. "STING orchestrates the neuronal inflammatory stress response in multiple sclerosis." Cell (2024).
4. Zhang, Yao, et al. "TWIST1+ FAP+ fibroblasts in the pathogenesis of intestinal fibrosis in Crohn’s disease." The Journal of Clinical Investigation (2024).
5. Bie, Juntao, et al. "PKM2 aggregation drives metabolism reprograming during aging process." Nature Communications 15.1 (2024): 5761.
6. Han, Bing, et al. "Tumor suppressor KEAP1 promotes HSPA9 degradation, controlling mitochondrial biogenesis in breast cancer." Cell Reports 43.7 (2024).
7. Babey, Muriel E., et al. "A maternal brain hormone that builds bone." Nature (2024): 1-9.
8. Klingbeil, Olaf, et al. "MARK2/MARK3 kinases are catalytic co-dependencies of YAP/TAZ in human cancer." Cancer Discovery (2024).
應用:肝癌靶點研究
來源:Deubiquitylase OTUD3 regulates integrated stress response to suppress progression and sorafenib resistance of liver cancer. Cell Reports (2024).

(圖源:去泛素化酶OTUD3通過ISR調控機制克服肝癌拉非尼耐藥 [1])
張令強團隊在《Cell Reports》雜志上發表的研究成果顯示,去泛素化酶OTUD3通過去除真核起始因子2α(eIF2α)的K27型泛素化修飾,有效抑制了肝癌細胞中的整合應激反應(ISR)激活,進而抑制肝癌的進展和對索拉非尼的耐藥性。研究發現,在小鼠模型中OTUD3的缺失會導致ISR激活增強和肝細胞癌進展加速。臨床肝癌組織中OTUD3表達的減少與ISR激活增強和不良預后顯著相關。此外,癌細胞通過降低OTUD3表達來激活ISR,從而抵抗索拉非尼的藥物治療,而聯合使用ISR抑制劑ISRIB能顯著提高肝癌細胞對索拉非尼的敏感性。這項研究不僅揭示了ISR通路調控的新機制,而且為肝癌治療提供了新的策略,即通過聯合使用ISR抑制劑來克服索拉非尼耐藥性,為肝癌患者帶來新的希望。
靶點:LILRB1
應用:結核病研究
來源:LILRB1-HLA-G axis defines a checkpoint driving natural killer cell exhaustion in tuberculosis. EMBO Molecular Medicine (2024).

(圖源:阻斷LILRB1–HLA-G信號軸可逆轉宿主NK細胞抵抗Mtb的免疫功能 [2])
中國科學院微生物研究所劉翠華團隊在《EMBO Molecular Medicine》上發表的研究文章《LILRB1–HLA-G axis defines a checkpoint driving natural killer cell exhaustion in tuberculosis》揭示了結核分枝桿菌(M. tuberculosis, Mtb)慢性感染導致自然殺傷(NK)細胞功能耗竭的新機制。研究發現,在Mtb感染過程中,NK細胞表面的抑制性受體LILRB1表達上調,與巨噬細胞分泌的HLA-G分子結合,激活下游的酪氨酸磷酸酶SHP1/2,抑制MAPK信號通路,損害NK細胞的殺傷活性。通過人源化小鼠模型的實驗,研究團隊證明阻斷LILRB1與HLA-G的結合可以增強宿主NK細胞的抗Mtb感染能力,為開發基于宿主的TB免疫治療新手段提供了潛在靶點。該研究由汪靜研究員、高福院士和逄宇教授共同參與,為理解固有免疫細胞在結核病中的免疫活性及其調控機制提供了新的視角,對改善TB患者的免疫治療具有重要意義。
靶點:STING
應用:神經元的炎性損傷研究
來源:STING orchestrates the neuronal inflammatory stress response in multiple sclerosis. Cell (2024).

(圖源:STING抑制劑保護炎癥引起的神經退行性病變 [3])
德國漢堡-埃彭多夫大學醫學中心Manuel A. Friese領導的研究團隊在《Cell》雜志上發表的研究發現STING蛋白在多發性硬化癥(MS)中扮演了核心調節者的角色。研究指出STING通過一種不依賴于cGAS和干擾素(IFN)的機制,整合了干擾素和谷氨酸信號,促進了自噬介導的GPX4降解,進而引發鐵死亡。這一發現為理解MS中的神經炎癥反應提供了新的視角,并可能有助于開發針對神經退行性病變的新治療策略。實驗中,STIM1的缺失導致神經元對炎癥相關神經退行性損傷的敏感性增加,而STING抑制劑的使用顯著降低了實驗性自身免疫性腦脊髓炎(EAE)模型中小鼠的神經元損傷,提高了GPX4水平,降低了自噬標志物LC3B的表達以及鐵死亡的發生,從而改善了神經元的炎性損傷。這些結果表明STING可能是治療MS相關神經退行性疾病的一個有前景的新靶點。
靶點:TWIST
應用:克羅恩病引起的腸纖維化研究
來源:TWIST1+ FAP+ fibroblasts in the pathogenesis of intestinal fibrosis in Crohn’s disease. The Journal of Clinical Investigation (2024).

(圖源:轉錄因子TWIST1在FAP+成纖維細胞的形成和激活中發揮關鍵作用 [4])
上海交通大學醫學院附屬瑞金醫院鄒多武教授團隊聯合上海市免疫學研究所蘇冰教授團隊在《The Journal of Clinical Investigation》上發表的研究揭示了克羅恩病腸纖維化的關鍵致病機制。研究團隊通過單細胞轉錄組測序技術構建了克羅恩病腸道纖維化的單細胞病理圖譜,發現腸道間質細胞在腸纖維化中起著核心作用,特別是FAP+成纖維細胞亞群,它們在纖維化部位顯著增多,是導致細胞外基質(ECM)過量沉積的主要細胞類型。進一步分析表明,轉錄因子TWIST1在FAP+成纖維細胞的形成和激活中發揮關鍵作用,而腸道CXCL9+巨噬細胞通過分泌IL-1β和TGF-β等細胞因子促進了TWIST1的表達。在小鼠模型中,通過特異性敲除TWIST1或使用TWIST1抑制劑Harmine,可以顯著改善腸纖維化。這些發現不僅為理解克羅恩病腸纖維化的病理過程提供了新的視角,也為開發新的治療策略提供了潛在的靶點,具有重要的臨床意義和應用前景。
靶點:PKM2
應用:抗衰老靶點研究
來源:PKM2 aggregation drives metabolism reprograming during aging process. Nature Communications (2024).

(圖源:靶向PKM2的抑制劑可延緩小鼠衰老 [5])
北京大學基礎醫學院的羅建沅教授團隊與李婷婷教授、劉小云研究員、陳軍副教授合作,在衰老生物學領域取得了重要進展。他們的研究團隊在《Nature Communications》上發表的研究論文指出,在衰老過程中,M2亞型丙酮酸激酶PKM2會發生異常聚集,這一現象對PKM2的酶活性和糖酵解通路產生了抑制作用,從而加速了衰老表型的出現。更為重要的是,該團隊通過高通量篩選技術,成功鑒定出兩種小分子化合物K35和K27,這些化合物能夠有效地抑制PKM2的聚集。在細胞和小鼠模型中的實驗顯示,這兩種化合物不僅能夠延緩細胞衰老,還能顯著恢復衰老小鼠的生理功能,并延長它們的壽命。這項研究的意義在于,它不僅首次揭示了PKM2聚集在衰老進程中的調控作用,而且為抗衰老藥物的開發提供了新的靶點。
靶點:KEAP1
應用:乳腺癌治療靶點
來源:Tumor suppressor KEAP1 promotes HSPA9 degradation, controlling mitochondrial biogenesis in breast cancer. Cell Reports (2024).

(圖源:KEAP1介導乳腺癌中線粒體生物發生 [6])
哈爾濱醫科大學的胡晶教授、李水潔教授和陳雪松教授的研究團隊在《Cell Reports》上發表的研究揭示了腫瘤抑制因子KEAP1在乳腺癌中調控線粒體生物發生的新機制。研究顯示,KEAP1與患者的預后呈正相關,并通過調節HSPA9的泛素化和降解來影響線粒體的生物發生和氧化磷酸化,這在乳腺癌細胞的增殖、凋亡和細胞周期轉變中起著至關重要的作用。作為細胞代謝的關鍵調控因子,KEAP1的這一新功能可能對乳腺癌的發生和發展產生顯著影響。研究還觀察到乳腺癌組織中線粒體相關蛋白表達的升高,強調了線粒體生物發生對維持線粒體穩定性的重要性。KEAP1通過負調控線粒體蛋白合成和氧化磷酸化,展現了其在乳腺癌線粒體生物發生中的新角色,為乳腺癌治療提供了潛在的生物標志物和治療靶點。
靶點:CCN3
應用:骨質疏松癥等骨骼疾病
來源:A maternal brain hormone that builds bone. Nature (2024).

(圖源:CCN3促進骨形成 [7])
加州大學的研究團隊在《Nature》期刊上發表了一項重要研究成果,他們發現了一種名為CCN3的新激素,被命名為“母體腦激素”(MBH)。這種激素能在哺乳期顯著提高女性的骨密度和骨強度,即使在大量鈣質轉移至乳汁中的情況下也不例外。CCN3不僅能幫助維持哺乳期婦女的骨骼健康,還展現出促進骨折愈合的潛力,并且能夠在較低的雌激素水平下促進骨骼干細胞分化和新骨細胞生成,從而增加骨量。這些特性表明CCN3可能成為治療骨質疏松癥等骨骼疾病的新方法。研究人員還開發出一種能夠緩慢釋放CCN3的水凝膠貼片,這種貼片在實驗中成功加速了老年小鼠骨折部位的愈合過程,凸顯了CCN3在臨床應用上的巨大潛力。
靶點:MARK2/3
應用:腫瘤研究
來源:MARK2/MARK3 kinases are catalytic co-dependencies of YAP/TAZ in human cancer. Cancer Discovery (2024).

(圖源:在類器官模型中,MARK2/3抑制劑能重新激活Hippo途徑介導的腫瘤抑制 [8])
冷泉港實驗室的Christopher R. Vakoc團隊在《Cancer Discovery》雜志上發表的研究中,發現了一種新的癌癥治療策略,即靶向MARK2/3激酶來抑制YAP/TAZ依賴性腫瘤的生長。通過CRISPR篩選,研究團隊確定了MARK2/3激酶對含有激活型YAP/TAZ的癌細胞系至關重要,并開發了一種MARK抑制肽(MKI),該肽模擬幽門螺桿菌CagA蛋白的EPIYA重復域,能有效抑制MARK激酶活性。在多種癌細胞系中,特別是胰腺癌和乳腺癌,MARK2/3的缺失顯著降低了YAP/TAZ的核轉移和致癌作用,而MKI的表達顯著抑制了腫瘤生長。這項研究不僅揭示了MARK2/3激酶在YAP/TAZ依賴性癌癥中的關鍵作用,而且為開發新的抗癌藥物提供了有希望的靶點,可能有助于克服現有治療方法中的耐藥性問題,為癌癥患者帶來新的治療選擇。
參考文獻
1. Dai, Hongmiao, et al. "Deubiquitylase OTUD3 regulates integrated stress response to suppress progression and sorafenib resistance of liver cancer." Cell Reports 43.7 (2024).
2. Wang, Jing, et al. "LILRB1-HLA-G axis defines a checkpoint driving natural killer cell exhaustion in tuberculosis." EMBO Molecular Medicine (2024): 1-36.
3. Woo, Marcel S., et al. "STING orchestrates the neuronal inflammatory stress response in multiple sclerosis." Cell (2024).
4. Zhang, Yao, et al. "TWIST1+ FAP+ fibroblasts in the pathogenesis of intestinal fibrosis in Crohn’s disease." The Journal of Clinical Investigation (2024).
5. Bie, Juntao, et al. "PKM2 aggregation drives metabolism reprograming during aging process." Nature Communications 15.1 (2024): 5761.
6. Han, Bing, et al. "Tumor suppressor KEAP1 promotes HSPA9 degradation, controlling mitochondrial biogenesis in breast cancer." Cell Reports 43.7 (2024).
7. Babey, Muriel E., et al. "A maternal brain hormone that builds bone." Nature (2024): 1-9.
8. Klingbeil, Olaf, et al. "MARK2/MARK3 kinases are catalytic co-dependencies of YAP/TAZ in human cancer." Cancer Discovery (2024).










