細(xì)胞分化決定細(xì)胞的命運(yùn)
日期:2023-12-05 16:01:00
細(xì)胞分化是細(xì)胞從一種類型轉(zhuǎn)變?yōu)槎喾N不同類型的過(guò)程。在細(xì)胞分化過(guò)程中,形態(tài)結(jié)構(gòu)和生理功能出現(xiàn)差異。所有生物都起源于一個(gè)單細(xì)胞。例如,人類是從受精卵發(fā)展而來(lái),這個(gè)過(guò)程涉及胚胎干細(xì)胞的分化。細(xì)胞分化在整個(gè)生命過(guò)程中都會(huì)發(fā)生。例如,造血干細(xì)胞分化為各種免疫細(xì)胞。
細(xì)胞異常分化可能導(dǎo)致癌細(xì)胞的產(chǎn)生。癌細(xì)胞無(wú)限分裂,形成腫瘤,危害人類健康。
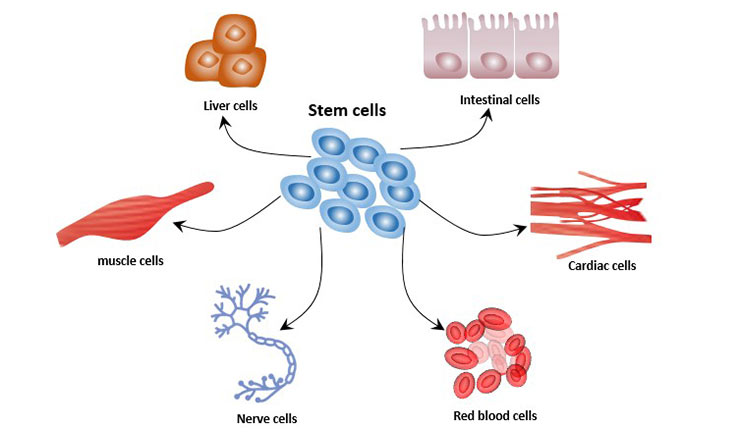
圖1. 干細(xì)胞的細(xì)胞分化
細(xì)胞分化涉及多種信號(hào)轉(zhuǎn)導(dǎo)過(guò)程:
1. MAPK信號(hào)通路
MAPK是一類線粒體中受體酪氨酸激酶的絲氨酸和酪氨酸雙重磷酸化的蛋白激酶。MAPK信號(hào)通路通過(guò)級(jí)聯(lián)反應(yīng)(MAPKKK-MAPKK-MAPK)激活轉(zhuǎn)錄因子并調(diào)控基因表達(dá)。MAPK能夠引起核內(nèi)轉(zhuǎn)錄因子的激活,參與細(xì)胞表面到細(xì)胞核的信號(hào)傳遞過(guò)程,調(diào)控細(xì)胞增殖和分化。
目前,已知有4條MAPK信號(hào)通路,包括細(xì)胞外信號(hào)調(diào)節(jié)激酶(ERK)、c-Jun N末端激酶(JNK,也稱為SAPK)、p38和ERK5通路。

圖2. MAPK信號(hào)通路
有關(guān)MAPK信號(hào)通路的更多信息,請(qǐng)參考以下鏈接:
http://www.tzmingka.cn/pathway/MAPK-signaling-pathway.html
1.1 ERK-MAPK信號(hào)通路
在MAPK信號(hào)通路中,ERK通路主要通過(guò)Ras-Raf-MEK-ERK級(jí)聯(lián)反應(yīng)起作用。
該通路的主要過(guò)程:生長(zhǎng)因子通過(guò)與酪氨酸激酶受體結(jié)合來(lái)激活受體,激活的酪氨酸激酶受體激活Ras蛋白,然后Ras蛋白磷酸化Raf,激活的Raf磷酸化下游的MEK。MEK可以磷酸化和激活ERK,將其轉(zhuǎn)移到細(xì)胞核,并通過(guò)激活其他激酶或轉(zhuǎn)錄因子來(lái)調(diào)控基因表達(dá)。
ERK-MAPK信號(hào)通路在間充質(zhì)干細(xì)胞(MSCs)向脂肪細(xì)胞的分化中起作用 [1] [2]。在脂肪細(xì)胞分化的早期,ERK1/2通過(guò)促進(jìn)C/EBPα和PPARγ的表達(dá)來(lái)促進(jìn)脂肪細(xì)胞分化。在脂肪細(xì)胞分化的后期,活化的ERK1/2會(huì)磷酸化PPARγ以使其失活,并抑制脂肪細(xì)胞分化。
該通路還可以影響紅細(xì)胞的增殖和分化。研究表明,ERK信號(hào)通路也參與成骨細(xì)胞分化和增殖的信號(hào)轉(zhuǎn)導(dǎo)。
1.2 JNK-SAPK通路
c-Jun N末端激酶(JNK),也稱為應(yīng)激激活蛋白激酶(SAPK),是哺乳動(dòng)物中的另一類MAPK亞類。JNK信號(hào)通路可以影響細(xì)胞生長(zhǎng)、細(xì)胞分化和細(xì)胞死亡等多種生命過(guò)程。JNK可以改變骨鈣素的mRNA水平,因此JNK的活化可以誘導(dǎo)成骨細(xì)胞分化。JNK信號(hào)通路在調(diào)節(jié)脂肪細(xì)胞分化中也起重要作用。
1.3 p38 MAPK通路
p38信號(hào)通路是MAPK家族的一個(gè)重要組成部分。p38 MAPK可以被多種細(xì)胞外應(yīng)激響應(yīng)激活,包括紫外線、輻射和促炎因子。
p38通路在間充質(zhì)干細(xì)胞(MSCs)的成骨分化中起著非常重要的作用。抑制p38 MARK通路會(huì)下調(diào)蛋白激酶C(PKC)的活性,而PKC在細(xì)胞的成骨分化中發(fā)揮重要作用。此外,轉(zhuǎn)化生長(zhǎng)因子和骨形態(tài)發(fā)生蛋白BMP-2通過(guò)p38 MAPK通路誘導(dǎo)Runx2/Cbfa1轉(zhuǎn)錄表達(dá)。其中,Runx2是影響成骨活性的關(guān)鍵靶基因,而Cbfa1在轉(zhuǎn)錄水平上調(diào)節(jié)MSCs向成骨細(xì)胞的分化。
p38信號(hào)通路調(diào)節(jié)干細(xì)胞的分化方向,可能與p53蛋白穩(wěn)定性的調(diào)節(jié)有關(guān) [3] [4]。
p38激酶激活的細(xì)胞可以分化為來(lái)源于中胚層的組織細(xì)胞,如心肌細(xì)胞、骨骼肌細(xì)胞和平滑肌細(xì)胞;而p38激酶被抑制的細(xì)胞則發(fā)展為外胚層細(xì)胞,最終分化為神經(jīng)細(xì)胞。
此外,ERK5/BMK1通路,這是一條非典型的MAPK通路,也參與了脂肪細(xì)胞分化和脂肪代謝的調(diào)節(jié)。
MAPK信號(hào)通路通過(guò)參與不同的途徑和分子來(lái)調(diào)節(jié)細(xì)胞分化。
2. 磷脂酰肌醇信號(hào)通路(PLC)
在磷脂酰肌醇信號(hào)通路中,細(xì)胞外信號(hào)分子結(jié)合到G蛋白偶聯(lián)受體上,激活貼壁脂酶C(PLC-β)位于細(xì)胞膜上,使磷脂酰肌醇(4, 5)二磷酸酯(PIP2)水解成肌醇1, 4, 5-三磷酸酯(IP3)和二酰基甘油(DG)。因此,磷脂酰肌醇信號(hào)通路(PLC)也被稱為“雙重信使系統(tǒng)”。
IP3打開(kāi)鈣通道并啟動(dòng)下游信號(hào)。Ca2+與鈣調(diào)蛋白(CaM)結(jié)合形成Ca2+-CaM復(fù)合物,激活腺苷酸環(huán)化酶(AC)和磷酸二酯酶(PDEs);激活Ca2+-CaM依賴性蛋白激酶。
DG激活PKC,磷酸化蛋白的絲氨酸/蘇氨酸殘基,產(chǎn)生不同的細(xì)胞反應(yīng),如細(xì)胞分泌、肌肉收縮、細(xì)胞增殖和分化。PLC-γ通路還參與紅細(xì)胞的分化。
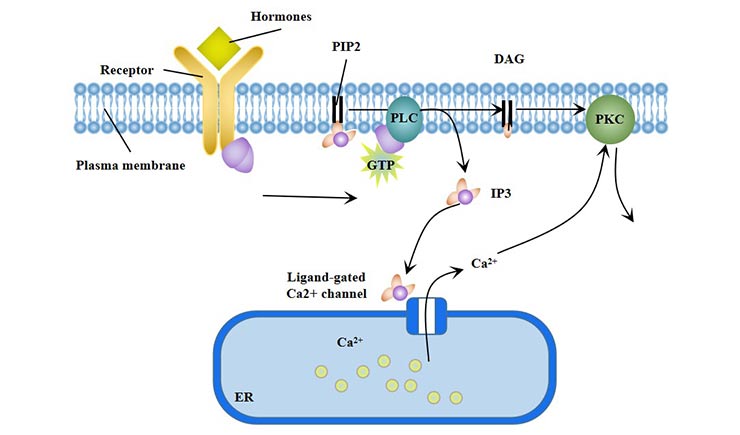
圖3. 磷脂酰肌醇信號(hào)通路(PLC)
3. cAMP/PKA信號(hào)通路
環(huán)狀腺苷酸單磷酸(cAMP)是一種重要的細(xì)胞內(nèi)信號(hào)分子,它激活cAMP依賴性蛋白激酶A(PKA)并調(diào)節(jié)細(xì)胞的分化。cAMP/PKA信號(hào)通路可以促進(jìn)間充質(zhì)干細(xì)胞(MSCs)的脂肪分化 [5],并抑制其成骨分化。
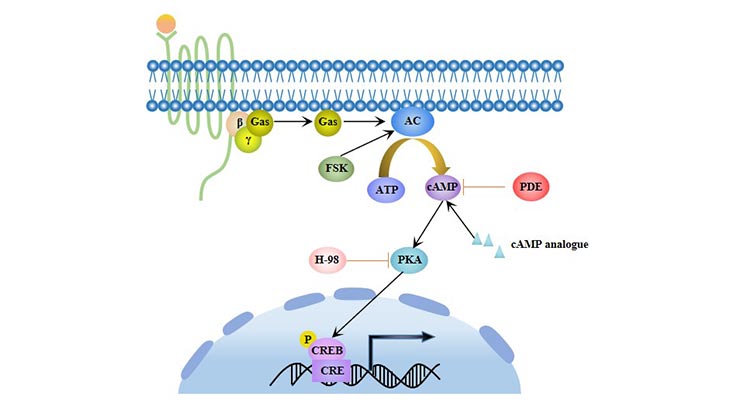
圖4. cAMP/PKA信號(hào)通路
4. JAK-STAT信號(hào)通路
JAK是一種酪氨酸激酶,其主要底物是轉(zhuǎn)錄因子STAT。激活的STAT轉(zhuǎn)位到細(xì)胞核并與DNA序列結(jié)合,從而調(diào)控基因表達(dá)。JAK-STAT信號(hào)通路在細(xì)胞增殖、凋亡和分化中起著重要作用。
該信號(hào)通路的主要過(guò)程如下:
配體與受體結(jié)合導(dǎo)致受體二聚化。二聚化的受體激活JAK,JAK磷酸化STAT。磷酸化的STAT形成二聚體,進(jìn)入細(xì)胞核并與DNA序列結(jié)合,從而調(diào)控基因表達(dá)。
JAK/STAT信號(hào)通路在紅細(xì)胞的增殖和分化中發(fā)揮重要作用 [6]。

圖5. JAK-STAT通路
5. PI3K-AKT-mTOR信號(hào)通路
哺乳動(dòng)物雷帕霉素靶蛋白(mTOR)是一種保守的絲氨酸/蘇氨酸蛋白激酶,有兩種主要形式:mTORC1和mTORC2。激活的mTOR在細(xì)胞增殖、分化和代謝中起著關(guān)鍵調(diào)控作用。
mTOR主要由PI3K/Akt/mTOR信號(hào)通路和LKB1/AMPK/mTOR信號(hào)通路調(diào)節(jié)。這兩個(gè)信號(hào)通路是調(diào)節(jié)睪丸支持細(xì)胞增殖和分化的主要途徑。在mTOR信號(hào)通路中,mTOR基因的缺失導(dǎo)致睪丸支持細(xì)胞數(shù)量減少。
研究表明,被PI3K激活的Akt激酶在造血過(guò)程中發(fā)揮重要作用。PI3K信號(hào)通路在小腸干細(xì)胞再生和促進(jìn)細(xì)胞分化中也很重要。

圖6. PI3K-AKT-mTOR信號(hào)通路
6. Notch信號(hào)通路
在Notch信號(hào)通路中,配體結(jié)合到Notch受體,導(dǎo)致細(xì)胞內(nèi)發(fā)生一系列信號(hào)轉(zhuǎn)導(dǎo)反應(yīng),最終導(dǎo)致細(xì)胞分化或保持未分化狀態(tài)。Notch配體包括Delta-like(Delta-like1, 3, 4)和Jagged(Jagged 1, 2)。
6.1 經(jīng)典Notch信號(hào)通路
未激活的Notch受體在經(jīng)過(guò)三次水解后釋放出可溶性的細(xì)胞內(nèi)域(NICD)。隨后,NICD與DNA結(jié)合轉(zhuǎn)錄因子CSL和核轉(zhuǎn)錄激活因子家族MAML一起轉(zhuǎn)移到細(xì)胞核,形成NICD-CSL-MAML三元轉(zhuǎn)錄激活復(fù)合物,最終激活下游靶基因的轉(zhuǎn)錄。
6.2 Notch信號(hào)通路與細(xì)胞分化
在干細(xì)胞中,Notch受體主要分布在干細(xì)胞表面。Notch通路調(diào)節(jié)干細(xì)胞的分化和增殖,在器官發(fā)育中起著重要作用。

圖7. 典型Notch信號(hào)通路
Notch信號(hào)通路調(diào)節(jié)著間充質(zhì)干細(xì)胞(MSCs)的增殖和分化,促進(jìn)MSCs向成骨細(xì)胞的分化。但是過(guò)度表達(dá)Notch可能會(huì)抑制骨骼形成。Notch通路還參與了腸道干細(xì)胞的分化。
研究證明,Notch信號(hào)和Wnt信號(hào)參與了干細(xì)胞分化為心臟肌細(xì)胞的過(guò)程,促進(jìn)了早期心臟肌肉的分化,但抑制了晚期分化。不同時(shí)間信號(hào)通路的開(kāi)啟和關(guān)閉影響了干細(xì)胞在分化途徑上的命運(yùn)。因此,可以使用小分子化合物來(lái)調(diào)節(jié)特定的信號(hào)通路,從而觸發(fā)定向分化或增強(qiáng)分化誘導(dǎo)效率。
Notch信號(hào)通路在免疫系統(tǒng)中也起著重要作用。干預(yù)Notch信號(hào)通路可以導(dǎo)致T細(xì)胞分化受阻。
6.3 Notch信號(hào)通路與CD4+ T細(xì)胞分化
Notch信號(hào)通路通過(guò)調(diào)節(jié)CD4+T細(xì)胞的分化和功能,調(diào)節(jié)了機(jī)體的免疫功能,對(duì)維持機(jī)體免疫平衡和各種疾病的發(fā)展起著重要作用。
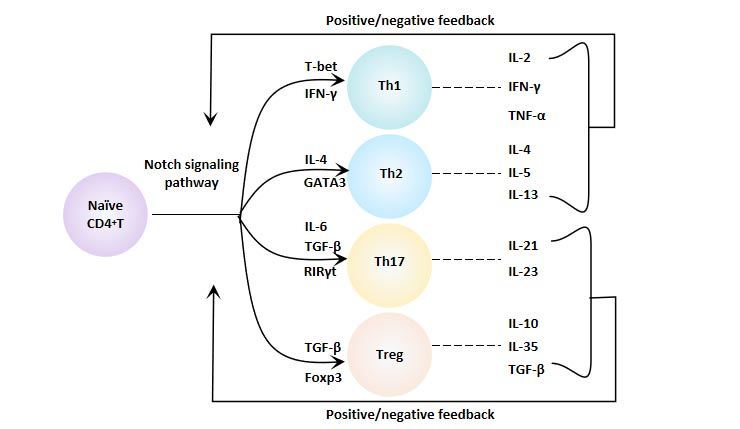
圖8. Notch信號(hào)通路與CD4+ T細(xì)胞分化
6.3.1 Notch信號(hào)與Th1細(xì)胞
Notch分子通過(guò)與TBX21啟動(dòng)子結(jié)合,直接調(diào)控T-bet基因編碼,從而調(diào)節(jié)Th1細(xì)胞的分化。Notch信號(hào)還通過(guò)與核因子κB(NF-κB)相互作用來(lái)促進(jìn)Th1細(xì)胞的分化。此外,Notch1還可以通過(guò)Akt/ERK/GSK3β信號(hào)軸實(shí)現(xiàn)“串話”,從而增強(qiáng)T細(xì)胞分化為Th1的過(guò)程。有效阻斷Notch通路可以有效限制Th1細(xì)胞的極化過(guò)程。
6.3.2 Notch信號(hào)與Th2細(xì)胞
T細(xì)胞中高表達(dá)的GATA-3與Th2細(xì)胞的極化密切相關(guān)。不成熟樹(shù)突狀細(xì)胞表達(dá)的Notch配體Jagged-1可以直接促進(jìn)GATA3的轉(zhuǎn)錄,并誘導(dǎo)CD4+ T細(xì)胞向Th2細(xì)胞的極化。Jagged-2可以在體外驅(qū)動(dòng)Th2細(xì)胞的分化,但在體內(nèi)不影響Th2細(xì)胞的極化。Notch信號(hào)分子可以通過(guò)IL-4和GATA3分別促進(jìn)Th2細(xì)胞的分化。
6.3.3 Notch信號(hào)與Th17細(xì)胞
RORγt是Th17細(xì)胞特異性轉(zhuǎn)錄因子。IL-17和RORγt是Notch信號(hào)的直接轉(zhuǎn)錄靶標(biāo)。Jagged-1-Notch信號(hào)通路可以抑制與Th17產(chǎn)生相關(guān)的細(xì)胞因子的表達(dá),如RORγt、IL-17A、IL-17F,從而抑制CD4+ T細(xì)胞向Th17細(xì)胞的分化。
總的來(lái)說(shuō),Notch信號(hào)通路在負(fù)調(diào)控Th17細(xì)胞的分化。然而,當(dāng)機(jī)體有高代謝需求時(shí),Notch可以通過(guò)影響細(xì)胞內(nèi)細(xì)胞因子轉(zhuǎn)運(yùn)加速釋放Th17細(xì)胞細(xì)胞因子,以抵消原來(lái)的效應(yīng)。因此,認(rèn)為Notch信號(hào)通路具有環(huán)境依賴性作用。
6.3.4 Notch信號(hào)與Treg細(xì)胞
調(diào)節(jié)性T細(xì)胞(Treg)的特征性轉(zhuǎn)錄因子是Foxp3。Notch信號(hào)通過(guò)轉(zhuǎn)錄水平調(diào)節(jié)Foxp3的表達(dá),并通過(guò)干細(xì)胞(SCs)誘導(dǎo)調(diào)節(jié)Treg細(xì)胞的誘導(dǎo)。研究表明,Notch/RBP-J/FOXP3/RORγt通路調(diào)節(jié)了Th17/Treg的平衡。
6.4 Notch信號(hào)通路與NSCs分化
神經(jīng)干細(xì)胞(NSCs)具有自我更新和多方向分化的能力,可以分化為神經(jīng)元、星形膠質(zhì)細(xì)胞和少突膠質(zhì)細(xì)胞。其增殖和分化受到Notch信號(hào)通路的調(diào)控。
Notch信號(hào)通路的激活抑制NSCs分化為神經(jīng)元,促進(jìn)NSCs分化為星形膠質(zhì)細(xì)胞,而阻斷Notch信號(hào)通路則促進(jìn)NSCs分化為神經(jīng)元。
7. Wnt信號(hào)通路
Wnt信號(hào)通路高度保守,其核心組件是β-catenin。
當(dāng)Wnt信號(hào)未被激活時(shí),細(xì)胞內(nèi)的β-catenin會(huì)被磷酸化并被蛋白酶體降解。
當(dāng)Wnt蛋白與其受體Frizzled和LRP結(jié)合時(shí),β-catenin降解復(fù)合物被非活化,β-catenin被釋放并在細(xì)胞內(nèi)積累。積累的β-catenin進(jìn)入細(xì)胞核,與轉(zhuǎn)錄因子和T細(xì)胞因子/淋巴細(xì)胞增強(qiáng)因子(TCF/LEF)結(jié)合,啟動(dòng)與增殖相關(guān)的一系列基因。
7.1 Wnt信號(hào)通路與脂肪細(xì)胞分化
激活Wnt信號(hào)通路可以抑制脂肪細(xì)胞的分化 [17],而一旦該通路失控,就會(huì)發(fā)生肥胖 [18]。
Wnt信號(hào)通路通過(guò)白細(xì)胞介素-6(IL-6)和腫瘤壞死因子α(TNF-α)激活,從而抑制β-catenin的降解。β-catenin進(jìn)一步抑制下游的C/EBP和PPAR,影響甚至阻止脂肪細(xì)胞的分化 [19]。
脂肪細(xì)胞的分化也受到PPARs信號(hào)通路和Hedgehog信號(hào)通路的影響。
PPAR家族在脂肪分化和代謝中發(fā)揮重要作用。其中,PPARγ作為脂肪分化的重要轉(zhuǎn)錄因子,可以加速脂肪細(xì)胞的分化和沉積 [20]。
Hedgehog(Hh)在細(xì)胞分化中也起著關(guān)鍵作用。
Hh信號(hào)通路在脂肪細(xì)胞分化過(guò)程中起著重要調(diào)節(jié)作用,但不足以觸發(fā)脂肪細(xì)胞分化 [21]。
7.2 Wnt信號(hào)通路與軟骨分化
激活Wnt信號(hào)通路可以促進(jìn)軟骨細(xì)胞分化。在軟骨分化中,Wnt信號(hào)通路與許多其他通路共同促進(jìn)間充質(zhì)干細(xì)胞的軟骨分化。
在軟骨分化中,TGF-β和Wnt信號(hào)通路共同促進(jìn)間充質(zhì)干細(xì)胞的軟骨分化。
此外,Wnt信號(hào)通路還可以促進(jìn)小腸干細(xì)胞的分化和心肌細(xì)胞的分化,并促進(jìn)睪丸支持細(xì)胞的增殖和分化。
8. TGF-β超家族信號(hào)通路
TGF-β超家族調(diào)節(jié)細(xì)胞的生長(zhǎng)、增殖、分化、遷移和凋亡,調(diào)控胚胎發(fā)育,參與機(jī)體的免疫反應(yīng),具有多功能的生物活性[22]。TGF-β信號(hào)通路影響睪丸支持細(xì)胞的增殖和分化。
參考文獻(xiàn):
[1] BOST F, Caron L, MARCHETTI I, et al. Retinoic acid activation of the ERK pathway is required for embryonic stem cell commitment into the adipocyte lineage [J]. Biochemical Journal, 2002, 361(3): 621-627.
[2] Liao Q C, Li Y L, Qin Y F, et al. Inhibition of adipocyte differentiation by phytoestrogen genistein through a potential downregulation of extracellular signal-regulated kinases 1/2 activity [J]. Journal of cellular biochemistry, 2008, 104(5): 1853-1864.
[3] Aouadi M, BOST F, Caron L, et al. p38 Mitogen-Activated Protein Kinase Activity Commits Embryonic Stem Cells to Either Neurogenesis or Cardiomyogenesis [J]. Stem Cells (Miamisburg), 2006, 24(5): 1399-1406.
[4] Hadjal Y, Hadadeh O, Yazidi C, et al. A p38mapk-p53 cascade regulates mesodermal differentiation and neurogenesis of embryonic stem cells [J]. Cell Death and Disease, 2013, 4(7): e737.
[5] Li H, Fong C, Chen Y, et al. Beta-adrenergic signals regulate adipogenesis of mouse mesenchymal stem cells via cAMP/PKA pathway [J]. Molecular and Cellular Endocrinology, 2010, 323(2): 201-207.
[6] Dan X. Protein tyrosine phosphatases in the JAK/STAT pathway [J]. Frontiers in Bioscience, 2008, Volume(13): 4925-.
[7] Saha S, Ji L, De Pablo J J, et al. TGFβ/Activin/Nodal Pathway in Inhibition of Human Embryonic Stem Cell Differentiation by Mechanical Strain [J]. Biophysical Journal, 2008, 94(10): 4123-4133.
[8] Willems E, Lanier M, Forte E, et al. A Chemical Biology Approach to Myocardial Regeneration [J]. Journal of Cardiovascular Translational Research, 2011, 4(3): 340-350.
[9] Yashiroohtani Y, Ohtani T, Pear W S. Notch regulation of early thymocyte development [J]. Seminars in Immunology, 2010, 22(5): 261-269.
[10] Verma N K, Fazil M H U T, Ong S T, et al. LFA-1/ICAM-1 Ligation in Human T Cells Promotes Th1 Polarization through a GSK3? Signaling-Dependent Notch Pathway [J]. The Journal of Immunology, 2016.
[11] Roderick J E , Gonzalezperez G , Kuksin C A , et al. Therapeutic targeting of NOTCH signaling ameliorates immune-mediated bone marrow failure of aplastic anemia.[J]. Rare Diseases, 2013, 210(1):1311-29.
[12] Liotta F, Frosali F, Querci V, et al. Human immature myeloid dendritic cells trigger a TH2-polarizing program via Jagged-1/Notch interaction [J]. Journal of Allergy and Clinical Immunology, 2008, 121(4): 1000-1005.
[13] Krawczyk C M, Sun J, Pearce E J. Th2 Differentiation Is Unaffected by Jagged2 Expression on Dendritic Cells [J]. The Journal of Immunology, 2008, 180(12): 7931-7937.
[14] Coutaz M, Hurrell B P, Auderset F, et al. Notch regulates Th17 differentiation and controls trafficking of IL-17 and metabolic regulators within Th17 cells in a context-dependent manner [J]. Sci Rep, 2016, 6: 39117.
[15] Li H, Wang L, Pang Y, et al. In patients with chronic aplastic anemia, bone marrow–derived MSCs regulate the Treg/Th17 balance by influencing the Notch/RBP-J/FOXP3/RORγt pathway [J]. Scientific Reports, 2017, 7: 42488.
[16] Woo S M, Kim J, Han H W, et al. Notch signaling is required for maintaining stem-cell features of neuroprogenitor cells derived from human embryonic stem cells [J]. Bmc Neuroscience, 2009, 10(1): 97-0.
[17] Baron R, Kneissel M. WNT signaling in bone homeostasis and disease: from human mutations to treatments [J]. Nature Medicine, 2013, 19(2): 179-192.
[18] Gong M, Liu C, Zhang L, et al. Loss of the TNFα function inhibits Wnt/β-catenin signaling, exacerbates obesity development in adolescent spontaneous obese mice [J]. Molecular and Cellular Biochemistry, 2014, 391(1-2): 59-66.
[19] Gustafson B, Smith U. Cytokines Promote Wnt Signaling and Inflammation and Impair the Normal Differentiation and Lipid Accumulation in 3T3-L1 Preadipocytes [J]. Journal of Biological Chemistry, 2006, 281(14): 9507-9516.
[20] Frazier-Wood A C, Ordovas J M, Straka R J, et al. The PPAR alpha gene is associated with triglyceride, low-density cholesterol and inflammation marker response to fenofibrate intervention: the GOLDN study [J]. The Pharmacogenomics Journal, 2013, 13(4): 312-317.
[21] Fontaine C, Cousin W, Plaisant M, et al. Hedgehog Signaling Alters Adipocyte Maturation of Human Mesenchymal Stem Cells [J]. STEM CELLS, 2008, 26(4): 10.
[22] Akhurst R J, Hata A. Targeting the TGFβ signalling pathway in disease [J]. Nature Reviews Drug Discovery, 2012, 11(10): 790-811.
上一篇: 神經(jīng)元標(biāo)志物與神經(jīng)退行性疾病
下一篇: 細(xì)胞活力概述










