自然殺傷細胞的表面標記
日期:2019-11-07 15:44:34
NK細胞,也稱為自然殺傷細胞,是細胞毒性淋巴細胞的一種,對先天免疫系統至關重要。它是于1975年因其形態特異性得以發現和命名,是由骨髓中的共同淋巴前體細胞發育而來。NK細胞在腫瘤和病毒感染細胞的宿主排斥中起主要作用。NK細胞通過釋放稱為穿孔素和顆粒酶的蛋白質殺死細胞,導致靶細胞的程序性細胞死亡。NK細胞也可以釋放大量的細胞因子和趨化因子來發揮其免疫作用,這些物質包括TNF-α,IFN-γ,IL-3,IL-10,GM-CSF,G-CSF,CCL2,CCL3,CCL4,CCL5和XCL1。
1. 自然殺傷細胞的體外擴增培養
關于NK細胞的體外擴增培養,目前主要有兩種方法:滋養層細胞培養方式和純因子細胞培養方式。
- 滋養層細胞培養方式:滋養層細胞(人腫瘤細胞,即人白血病K562細胞)是具有不分裂不增殖但仍保持代謝活性的細胞。該細胞細胞膜表面穩定表達的多種細胞因子可促進外周血單核細胞中的自然殺傷細胞的定向激活和擴增。
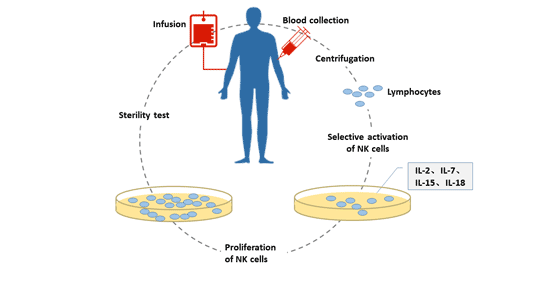
圖1. 自然殺傷細胞的體外培養
2. NK細胞表面標志物
所有的細胞都有其特有的標記,這些標記可以是蛋白質、脂類、糖基化等,它們可以用于區分不同的細胞類型。
細胞標志物既可以在細胞外表達,也可以作為細胞內分子表達。
很長一段時間,NK細胞被認為缺乏表面抗原,被稱為“裸淋巴細胞”。現在,人們已經知道NK細胞表達大量受體。不同種屬中,NK細胞的表面標志物存在一些差異。人類和小鼠中的NK細胞表達表面標記差異如下:
小鼠:CD49b (clone DX5)
此外,高達80%的人類NK細胞也表達CD8。以下是一些NK細胞的一些標志物。
NK細胞標志物可分為兩種類型:細胞內標記和細胞外標記。
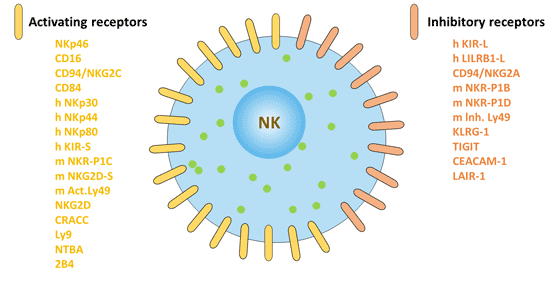
圖2. 自然殺傷細胞的表面標記:激活受體和抑制受體
2.1 細胞內標記
顆粒溶解素(Granulysin)
顆粒酶B(Granzyme B)
穿孔素(Perforin)
2.2 細胞外標記
2.2.1 CD16
CD16是自然殺傷(NK)細胞表達的表面受體,NK細胞上的CD16是完全跨膜的,具有ITAM的細胞質尾巴,而不是通過GPI錨連接。它是一種免疫球蛋白Fc受體,它能夠觸發細胞的殺傷效應,允許NK細胞介導抗體依賴性殺傷(ADCC)[1]。NK細胞CD16的表達與信號轉導亞基zeta相關,CD16激活NK細胞導致zeta酪氨酸磷酸化。
2.2.2 CD56
CD56,也稱為神經細胞粘附分子,它是一種200-220 kDa的糖蛋白,主要在人NK細胞和少數介導MHC的T淋巴細胞上表達。CD56具有五個胞外遠端IGSF結構域和兩個近端纖連蛋白樣III結構域。CD56能夠在兩個細胞之間或在同一細胞上進行同源二聚化。它為突觸生長和神經肌肉相互作用提供重要信號。CD56對NK細胞的作用可能是粘附。
根據NK細胞表面分化抗原56(Cluster of differentiation, CD)密度的不同,人NK細胞可以分為CD56 dim 和CD56 bright 2個亞群。CD56 dim具有殺傷靶細胞的細胞毒活性,是NK細胞的主要組成,約占其總數的(90-95)%;CD56 bright細胞以分泌免疫調控因子為主,大約占NK細胞的(5-10)%。
2.2.3 CD94
CD94在NK細胞的表面以與NKG2A同型或異型的形式展示。一旦CD94-NKG2A復合物與配體結合,它對NK細胞具有很強的抑制能力。盡管CD94和二聚體具有不同的作用機理,但是它們也具有抑制能力。它可能與逃避NK細胞的病毒有關。
2.2.4 CD160
在細胞毒性NK細胞中,CD160以GPI或跨膜的形式存在,它主要表達于NK細胞的細胞毒性亞群(CD56dim / CD16 +)中。此外,它也在γ/δT細胞和一小部分含有顆粒酶和穿孔素的CD8LightαβT上表達。它也可以在小腸上皮的CD8 + T中表達。
在NK細胞中,CD160可增強細胞激活和細胞毒性,并激活細胞因子IFN-γ,IL-6,IL-8和TNF-α的分泌。
2.2.5 NK細胞的其他表面標志物
CD2:CD2是自然殺傷細胞的表面蛋白[2]。它是一種NK細胞觸發受體,大小為50-55 kDa,在T細胞上也有表達。當與腫瘤細胞上的配體結合時,CD2家族成員調節自然殺傷(NK)細胞的裂解活性和炎性細胞因子的產生。
2B4 (CD244):是免疫球蛋白超家族分子CD2子集的成員,在自然殺傷(NK)細胞和其他白細胞上表達[3]。
BAT:它可以將NK細胞與T細胞和B細胞的其他已知子集區分開[4]。
CD45:細胞表面磷酸酶CD45在NK細胞發育和激活受體的細胞內信號轉導中的作用,是誘導NK細胞反應的一個關鍵酶[5]。
CD57/HNK1:CD57是自然殺傷(NK)細胞標志物,它可與包括外周血中所有自然殺傷(NK)細胞在內的人類白細胞發生反應。
CD69:CD69是NK細胞激活標記物[6]。它可形成二聚體表達于活化的T細胞、B細胞、自然殺傷細胞、中性粒細胞和血小板表面,是一類與自然殺傷細胞活化抗原家族相關的II型膜糖蛋白。它在NK細胞功能中起著關鍵作用,有助于維持NK細胞的激活。
CD107a:鑒定天然殺傷細胞活性的功能標記[7]。
CD161:NK細胞激活標記物[6]。
CD335/NKp46:一種參與人NK細胞活化的細胞表面受體。由NK細胞表達的主要殺傷受體。
CD314(KLRK1):在自然殺傷(NK)細胞中表達,激活殺傷細胞(NK)的先天免疫反應,導致細胞毒性活動。參與NK細胞介導的骨髓移植排斥反應。可能對NK細胞的分化和存活起調節作用。
HP (Helix pomatia) Receptors:在NK細胞上檢測到的第一個簡單可靠的標記物,可能對純化這種細胞類型有用。
LAT (linker for activation of T cells):LAT是36-38 kDa的完整膜蛋白,在T細胞活化中起重要作用,可作為T細胞,NK細胞,肥大細胞和巨核細胞的新型免疫組織化學標記。
Ly24 (Pgp-1):小鼠自然殺傷細胞在其表面表達Ly24 (Pgp-1)標記物。
Ly49H:是C57BL/6(B6)小鼠特有的NK細胞活化受體。
NKG2A and NKp80:恒河猴和豬尾猴中特定的自然殺傷細胞標記。
3. NK細胞表面受體的功能
NK細胞主要來源于骨髓淋巴樣干細胞,約占體內淋巴細胞的10%,主要分布于外周血和外周淋巴組織[8]。
根據結構的不同,NK細胞表面受體可分為免疫球蛋白超家族與C型凝集素超家族。根據功能的不同,NK細胞表面受體可分為殺傷細胞活化受體和殺傷細胞抑制受體。NK細胞表面表達的抑制性受體維持NK細胞對宿主自身正常組織細胞的耐受,NK細胞表面表達的活化性受體可與靶細胞表面相應配體結合,激發NK細胞產生殺傷作用。活化性受體和抑制性受體所介導的信號的平衡影響NK細胞對腫瘤的殺傷活性[9]。
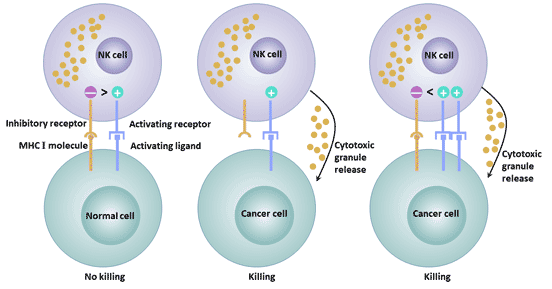
圖3. 活化性受體和抑制性受體的不同功能
4. 抗腫瘤免疫機制
NK細胞主要通過兩種方式發揮其抗腫瘤的功能:免疫清除和免疫監視。
免疫清除主要包括以下3個機制:
- 通過釋放細胞毒性顆粒殺傷腫瘤細胞。NK細胞可釋放穿孔素和顆粒酶,這兩者通過改變靶細胞滲透壓、激活凋亡酶相關系統使腫瘤細胞裂解凋亡。
- 通過細胞表面合成的蛋白激活靶細胞凋亡系統殺傷腫瘤細胞。活化的NK細胞表達FasL和TNF-α,這兩種蛋白與腫瘤細胞表面相應的受體Fas(CD95)、TNFR-1分別結合,形成Fas三聚體和TNF-R三聚體,啟動靶細胞的凋亡系統,從而殺傷靶細胞。
- 通過抗體依賴的細胞介導的細胞毒性作用(antibody-dependent cell-mediated cytotoxicity,ADCC)殺傷靶細胞。
除NK細胞自身對腫瘤細胞的直接殺傷作用外,活化的NK細胞可以分泌多種細胞因子,如TNF、IFN等協同其抑制或殺傷腫瘤細胞。
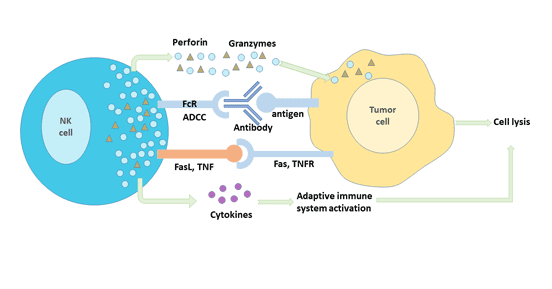
圖4. NK細胞的抗腫瘤免疫機制
5. NK細胞與腫瘤
NK細胞作為機體固有免疫系統中重要的組成部分,在腫瘤免疫方面發揮重要作用。NK細胞表面活化受體和抑制受體的表達決定其抗腫瘤能力的強弱。NK細胞在抑制肺癌、乳腺癌、大腸癌等惡性腫瘤的生長和轉移方面有一定的意義。
5.1 肺癌
NK細胞和穿孔素介導的細胞毒性作用對于肺癌的預防有一定的作用[10]。顆粒酶B、穿孔素的表達減少與肺癌之間有一定的關聯[11]。
NK細胞的免疫治療研究發現活化NK細胞可以抑制肺癌細胞的生長。肺癌的發生與NK細胞數量的減少及其活性的降低密切相關。因此提高NK細胞活性、增加NK細胞數量是防治肺癌發生發展的重要免疫治療手段。
5.2 乳腺腫瘤
乳腺腫瘤的生長轉移同樣與NK細胞的活性密切相關。乳腺癌患者NK細胞活性明顯下降,而且其表面活化性受體表達受到限制,而抑制性受體水平明顯升高[12]。
5.3 白血病
白血病患者NK細胞中抑制性受體NKG2A的表達顯著升高,而活化性受體NKP46明顯降低,這使得NK細胞殺傷活性降低[13]。通過調節NK細胞表面受體的表達可以改變其活性,增強其免疫功能。
6. NK細胞在腫瘤免疫治療中的應用
根據NK細胞的抗腫瘤免疫機制,可應用相應的方法對腫瘤進行治療。
6.1 抗體介導的NK細胞的細胞毒作用
它是基于抗體依賴的細胞介導的細胞毒性作用(ADCC)而形成的治療方法。它能夠靶向殺傷腫瘤細胞或者增強NK細胞的ADCC作用。
例如,在CD137單克隆抗體的作用下,NK細胞的CD137表達提高,作為活化信號分子,它使得NK細胞在脫顆粒、分泌IFN-γ和抗腫瘤活性方面能力明顯增強[14]。
CCR4單抗提高NK細胞的ADCC作用[15]。
6.2 供受者KIR-HLA不匹配與NK細胞抗腫瘤效應
NK細胞既能對體內正常細胞產生免疫耐受,又可以殺傷腫瘤細胞。
對于正常細胞,NK細胞通過表面抑制型KIR受體識別細胞的HLA-Ⅰ類分子,轉導殺傷抑制性信號,阻止NK細胞對正常細胞的殺傷。對于腫瘤細胞,其表面缺乏HLA-Ⅰ類信號分子,容易被NK細胞識別并攻擊。供受者KIR-HLA不匹配可引起NK細胞的異源反應性,激活供者NK細胞殺傷受者細胞。
這種方法在應用于治療髓性白血病和淋巴細胞白血病時,能有效增強移植物抗白血病效應[16],提高患者的生存率。在腎癌、胃癌、腸癌、卵巢癌等實體瘤治療中,也取得較好的治療效果[17]。
References
[1] Vivier E, Morin P M, OBrienm C, et al. CD2 is functionally linked to the ζ‐natural killer receptor complex [J]. European journal of immunology, 1991, 21(4): 1077-1080.
[2] Lynn D J, Freeman A R, Murray C, et al. A Genomics Approach to the Detection of Positive Selection in Cattle: Adaptive Evolution of the T-Cell and Natural Killer Cell-Surface Protein CD2 [J]. Genetics, 2005, 170(3): 1189-1196.
[3] Boles K S, Stepp S E, Bennett M, et al. 2B4 (CD244) and CS1: novel members of the CD2 subset of the immunoglobulin superfamily molecules expressed on natural killer cells and other leukocytes [J]. Immunological reviews, 2001, 181(1): 234-249.
[4] Habu S, Hayakawa K, Okumura K, et al. Surface markers on natural killer cells of the mouse [J]. European journal of immunology, 1979, 9(12): 938-942.
-1433.[6] Coulam C B, Roussev R G. Correlation of NK cell activation and inhibition markers with NK cytoxicity among women experiencing immunologic implantation failure after in vitro fertilization and embryo transfer [J]. Journal of assisted reproduction and genetics, 2003, 20(2): 58-62.
[7] Alter G, Malenfant J M, Altfeld M. CD107a as a functional marker for the identification of natural killer cell activity [J]. Journal of immunological methods, 2004, 294(1-2): 15-22.
[8] Cheng M, Chen Y, Xiao W, et al. NK cell-based immunotherapy for malignant diseases [J]. Cellular & molecular immunology, 2013, 10(3): 230.
[9] Peruzzi G, Masilamani M, Borrego F, et al. Endocytosis as a mechanism of regulating natural killer cell function: unique endocytic and trafficking pathway for CD94/NKG2A [J]. Immunologic research, 2009, 43(1-3): 210-222.
[10] Frese-Schaper M, Keil A, Yagita H, et al. Influence of natural killer cells and perforin-mediated cytolysis on the development of chemically induced lung cancer in A/J mice [J]. Cancer immunology, immunotherapy, 2014, 63(6): 571-580.
[11] Hodge G, Barnawi J, Jurisevic C, et al. Lung cancer is associated with decreased expression of perforin, granzyme B and interferon (IFN)‐γ by infiltrating lung tissue T cells, natural killer (NK) T‐like and NK cells [J]. Clinical & Experimental Immunology, 2014, 178(1): 79-85.
[12] Mamessier E, Sylvain A, Thibult M L, et al. Human breast cancer cells enhance self tolerance by promoting evasion from NK cell antitumor immunity [J]. The Journal of clinical investigation, 2011, 121(9): 3609-3622.
[13] Stringaris K, Sekine T, Khoder A, et al. Leukemia-induced phenotypic and functional defects in natural killer cells predict failure to achieve remission in acute myeloid leukemia [J]. Haematologica, 2014, 99(5): 836-847.
[14] Lin W, Voskens C J, Zhang X, et al. Fc-dependent expression of CD137 on human NK cells: insights into “agonistic” effects of anti-CD137 monoclonal antibodies [J]. Blood, 2008, 112(3): 699-707.
[15] Kanazawa T, Hiramatsu Y, Iwata S, et al. Anti-CCR4 monoclonal antibody mogamulizumab for the treatment of EBV-associated T-and NK-cell lymphoproliferative diseases [J]. Clinical Cancer Research, 2014, 20(19): 5075-5084.
[16] Cooley S, Weisdorf D J, Guethlein L A, et al. Donor selection for natural killer cell receptor genes leads to superior survival after unrelated transplantation for acute myelogenous leukemia [J]. Blood, 2010, 116(14): 2411-2419.
[17] Re F, Staudacher C, Zamai L, et al. Killer cell Ig‐like receptors ligand‐mismatched, alloreactive natural killer cells lyse primary solid tumors [J]. Cancer, 2006, 107(3): 640-648.










